
Pathomechanismus der Eisenüberladung 
Hinweise auf eine eiseninduzierte Zell- und Organschädigung ergeben sich aus Studien in Patienten mit
genereller Eisenüberladung (primäre und sekundäre Hämosiderose), aus Versuchen mit experimenteller
Eisenüberladung an Versuchstieren oder Zellkulturen oder nach Beobachtung von lokalen, intramuskulären
Schäden nach der therapeutischen Injektion von Eisenverbindungen an Mensch und Versuchstier (1). 
Der genaue Mechanismus der toxischen Wirkung von Eisen in vivo auf verschiedene Gewebe ist im Detail
nicht abschließend bekannt. In der Leber, die in fast allen Fällen einer Eisenüberladung frühzeitig betroffen ist,
kann die eiseninduzierte Zellschädigung bekanntermaßen zu Leberfibrose, Leberzirrhose und in schweren
Fällen auch zu primärem Leberzellkarzinom führen. Auf molekularer Ebene ist möglicherweise die Oxidation
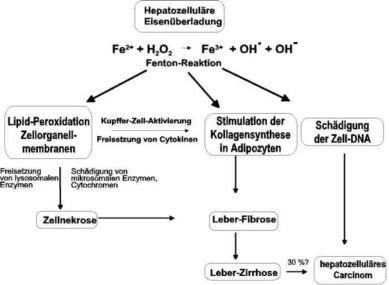
von mehrfach-ungesättigten Fettsäuren in Phospholipiden von Zell- oder Zellorganellmembranen der zentrale
Schritt auf dem Weg zu einer chronischen Zellschädigung (Abb. 2). Durch diese Lipidperoxidation wird die
Integrität von Zellen und von Zellorganellen (z.B. Lysosomen) gestört. Auch der Ausfall von
membrangebundenen Enzymen, die Freisetzung von lysosomalen Enzymen oder die toxische Wirkung von
Abbauprodukten der Lipide kann zu Zellschäden führen. Eisen spielt in vitro und wahrscheinlich auch in vivo
eine katalytische Rolle (Fenton-Reaktion) bei der Generation von hochreaktiven Hydroxylradikalen (OH.), die
benachbarte Moleküle (Lipide, Proteine, DNA) direkt „angreifen“ (2).
Abb. 2. Mögliche Faktoren der eiseninduzierten Organschädigung (hier Leber) bei Eisenüberladungs-
erkrankungen
Primäre, genetische Eisenüberladung, hereditäre Hämochromatose 
Der Begriff Hämochromatose geht auf von Recklinghausen zurück, der fälschlicherweise Hämoglobin als
Ursprung der Eisenablagerung in der Leber ansah. Unter diesem Begriff wurde anfangs eine Eisenüberladung
bei unterschiedlichen Grunderkrankungen verstanden (3,4). Die heute gängige Bezeichnung der hereditären
(Synonym: idiopathische, primäre) Hämochromatose wurde dann einige Zeit allein für die HLA-assozierte,
genetisch bedingte Form der Eisenüberladung verwendet (5). Heute kennen wir unter dem Begriff vier
verschiedene genetische Formen der Hämochromatose (siehe Hämochromatose).
Sekundär bedingte Eisenüberladung
Unter dem Begriff der sekundären Eisenüberladung wird eine Reihe von genetisch bedingten oder erworbenen
Krankheiten zusammengefasst, die auch zu einer progressiven Organsiderose und zu erhöhten
Eisenparametern im Blut führen können. Eine Übersicht ist in Tabelle 1 aufgeführt, wobei in der Literatur
unterschiedliche Auflistungen existieren.
“Iron-loading anemias” mit und ohne Transfusionen 
•
Thalassaemia major
•
Kongenitale Dyserythropoetische Anämien (CDA)
•
Sideroblastische Anämien
•
Transfusionssiderosen
•
Aplastische Anämien
•
Diamond-Blackfan-Anämie
•
Myelodysplastisches Syndrom
•
Sichelzellkrankheit
andere Formen
•
Nutritive Eisenüberladung
•
Chronische Lebererkrankungen
•
Hepatitis C und B
•
Alkohol-induzierte Lebererkrankung
•
Dysmetabolisches Syndrom
Tab. 1: Einteilung der sekundären Eisenüberladungen.
Posttransfusionssiderose
Am meisten Eisen wird Patienten durch Bluttransfusionen zugeführt, mit jeder Einheit transfundierten
Erythrozytenkonzentrates etwa 200 mg Eisen zugeführt. Die durchschnittliche tägliche Eisenzufuhr eines
regelmäßig transfundierten Thalassämiepatienten beträgt damit etwa 0,4-0,6 mg/kg. Da überschüssiges Eisen
aktiv nicht ausgeschieden werden kann, kommt es z.B. bei einem 12-jährigen Patienten mit ß-Thalassämia
major unter regelmäßiger Transfusionstherapie kommt es zur Akkumulation von mehr als 55 g Eisen in
Geweben, die normalerweise insgesamt nur ca. 2 g Eisen enthalten (15). Unter den Bedingungen einer regulär
geführten Transfusionstherapie ist mit einer Organschädigung ab einer zugeführten Menge von 500 g
Erythrozyten/kg – das entspricht etwa 500 mg Eisen/kg – zu rechnen (16).
Nutritiv bedingte Eisenüberladung?
Der auch in aktuellen Publikationen häufig zitierte Begriff des „Mukosa-Block“ wurde ursprünglich vor 65
Jahren formuliert, um die Herunterregulation der intestinalen Eisenabsorption als Reaktion auf eine
vorangegangener Eisengabe bei Versuchstieren zu beschreiben (18). Ob es diesen Effekt beim Menschen
überhaupt gibt, ist allerdings eher fraglich. So funktioniert eine orale Therapie mit täglichen Eisen-Dosis
bekanntermaßen gut und der „Mukosa-Block“ schützt auch keineswegs vor einer akuten Intoxikation durch
sehr hohe Eisendosen. So kann eine Einnahme von 180–300 mg Fe/kg Körpergewicht tödlich sein. Eine
Dosis von 10-20 mg Fe/kg gilt als nicht-akut-toxisch beim Menschen. 
Zutreffender ist es, von einer „Mukosa_Block-Intelligenz“ zu sprechen, die die Eisenabsorption nach dem
Bedarf an Eisen im Körper reguliert. Mit der Regulation der Hepcidinsynthese kennen wir heute einen
Mechanismus, der für diese Intelligenz verantwortlich ist. In einer aktuellen Arbeit fanden z.B. Roe et al.
retrospektiv in Serum-Proben aus einer Eisenabsorptionsstudie mit 54Fe und 57Fe markierten Testmahlzeiten,
dass interindividuelle Schwankungen in der Eisenabsorption zumindest teilweise mit den Plasmahepcidin-
Spiegeln erklärt werden können (19). 
In der Literatur wird heute diskutiert, wie effizient diese „Mukosa-Block-Intelligenz“ beim Menschen wirklich
funktioniert, und ob eine hohe Eisenzufuhr auf Dauer nicht unweigerlich zu einer exzessiven Eisenspeicherung
führen muss (20,21). Als Beispiel wird oft die historisch interessante Bantu-Siderose angeführt, die durch das
tägliche Trinken von großem Mengen traditionell in Eisentöpfen gebrauten Biers in Nordafrika hervorgerufen
wurde. Man hat die zugeführten Mengen an Eisen auf 50-100 mg/Tag kalkuliert, was häufig zu Leberzirrhose,
Diabetes und Herzinfarkten führen kann. Durch Verwendung von Edelstahl- oder Kunststoffgefäße konnte
dieses Problem leicht gelöst werden. Einschränkend muss angeführt werden, dass Alkohol einen direkten
Einfluss auf Eisenabsorption haben kann. Neuere Studien legen auch eine genetische Ursache der
Afrikanischen Siderose nahe, obwohl ein definierter Gendefekt bisher nicht gefunden werden konnte (22). Aus
den Erfahrungen mit der Bantu-Siderose kann man mit einem Sicherheitsfaktor von 2 das obere Limit für eine
Nahrungseisenzufuhr mit 25-50 mg/Tag festlegen.
Im Rahmen von z.B. Eisenfortifizierungsprogrammen zur Eisenmangelprophylaxe wird deshalb immer wieder
vor adversen Effekten gewarnt (23). Besonders gefährdet erscheinen Genträger für die C282Y-Mutation zu
sein (Häufigkeit in der Normalbevölkerung ca. 10 %), da diese etwas vermehrt Eisen aus einer normalen Diät
aufnehmen können. In Studien mit markierten Testmahlzeiten hat man diesen Effekt allerdings bisher nicht
eindeutig nachweisen können. Auch sprechen epidemiologische Erkenntnisse aus vielen Studien über
Hämochromatosepatienten eher dagegen, denn Genträger entwickeln im Laufe des Lebens nur in ganz
wenigen Ausnahmefällen deutlich erhöhte biochemische Parameter einer Eisenüberladung und zeigen so gut
wie nie klinische Symptome einer Hämochromatose (24).
In diesem Zusammenhang muss auch die „Eisen-Hypothese“ erwähnt werden, die breiten Raum in der
Literatur und in Diskussionen im Internet einnimmt und nach der erhöhte Eisenspeicher als Risikofaktor für
verschiedene Krankheiten (koronare Herzkrankheit, Diabetes, neurodegenerative Erkrankungen) angesehen
werden. In vielen Studien werden dabei erhöhte Serum-Ferritin-Werte als Surrogat-Marker für ein
eiseniduziertes Risiko für Zell- und Organschäden am Patienten angeführt (20,21). Das wichtigste Argument
gegen diese „Ferritin-basierte Eisen-Hypothese“ ist, dass Serum-Ferritin als akut-phase-Protein bei vielen
Krankheiten sekundär erhöht vorliegt und deshalb nicht zuverlässig erhöhte Eisenspeicher anzeigen kann. Ob
diese Patienten wirklich leicht erhöhte Eisenspeicher haben und ob hier Eisen als Co-Faktor eine Rolle spielt,
konnte bisher weder schlüssig nachgewiesen noch eindeutig ausgeschlossen werden. Unzählige Versuchen
an Zellkulturen und in Tierversuchen unter Eisenüberladung weisen nach, wie Eisen in Zellen akkumulieren
und zu vermehrten Schäden durch oxidativem Stress führen kann. Klar ist aber auch, dass wir antioxidative
Abwehrstrategien haben, die durch Eisenüberladung sogar stimuliert werden können und vermehr zur
Verfügung stehen können.
Zusammenfassend ist damit die eigentlich relevante Frage: Mit wie viel Eisen können unsere antioxidativen
Mechanismen auf Dauer umgehen? Klinische Erfahrungen bei Patienten mit teilweise jahrzehntelang
schwerer Eisenüberladung (Hämochromatose, ß-Thalassämie) zeigen keine statistische Häufung von z.B.
Herzinfarkten oder Krebserkrankungen (6,9,10). Bei einzelnen Patienten kann die es aber zu einer
gefährlichen Dekompensation in bestimmten Organen kommen (unbeherrschbarer Diabetes, Herzversagen bei
ß-Thalassämie; primäres hepatozelluläres Carcinom bei Patienten mit vorhandener Leberzirrhose). Bricht
man diese Erfahrungen auf das Risiko in der Normalbevölkerung herunter, dann kann die Wirkung von leicht
erhöhten Eisenspeicher eigentlich nur sehr gering sein.
Literatur
1.
Britton RS, Ferrali M, Magiera CJ, Recknagel RO, Bacon BR. Increased prooxidant action of hepatic cytosolic
low-molecular-weight iron in experimental iron overload. Hepatology 1990; 11:1038-1043
2.
Imlay JA, Chin SM, Linn S, Toxic DNA damage by hydrogen peroxide through the Fenton reaction in vivo and in
vitro. Science 1988; 240: 640-642
3.
von Recklinghausen FD. Tageblatt der 62. Versammlung Deutscher Naturforscher und Ärzte in Heidelberg, 1889;
324-325
4.
Sheldon JH. Haemochromatosis, Oxford University press, London 1935
5.
Simon M, Alexandre JL, Bourel M, LeMarec B, Scordia C. Heredity of idiopathic hemochromatosis: a study of 106
families. Clin Genet 1977; 11:327-341.
6.
Pietrangelo A. Hereditary Hemochromatosis - A new look at an old disease. New Engl J Med 2004; 350:2383-
2397
7.
Adams PC, Reboussin DM, Barton JC, McLaren CE, Eckfeldt JH, McLaren GD, Dawkins FW, Acton RT, Harris
EL, Gordeuk VR, Leiendecker-Foster C, Speechley M, Snively BM, Holup JL, Thomson E, Sholinsky P.
Hemochromatosis and Iron Overload Screening (HEIRS) Study: Screening of a primary care population. New
Engl J Med 2005; 352:1769-1778
8.
Schumacher HR. Hemochromatosis and Arthritis. Arthritis Rheumatol 1964; 7:41-50
9.
Beutler E, Felitti VJ, Koziol JA, Ho JN, Gelbart T. Penetrance of 845G*A (C282Y) HFE hereditary
haemochromatosis mutation in the USA. Lancet 2002; 359:211-18
10.
Asberg A, Hveem K, Thorstensen K, Ellekjter E, Kannelonning K, Fjosne U, Halvorsen TB, Smethurst HB, Sagen
E, Bjerve KS: Screening for hemochromatosis: high prevalence and low morbidity in an unselected population of
65,238 persons. Scand J Gastroenterol 2001; 36:1108-1115
11.
Deugnier Y, Mosser J. Modifying factors of the HFE hemochromatosis phenotype. Expert Rev Gastroenterol
Hepatol. 2008 Aug;2(4):531-40.
12.
Island ML, Jouanolle AM, Mosser A, Deugnier Y, David V, Brissot P, Loréal O. A new mutation in the hepcidin
promoter impairs its BMP response and contributes to a severe phenotype in HFE related hemochromatosis.
Haematologica. 2009 Mar 13. [Epub ahead of print] Links
13.
Casanovas G, Mleczko-Sanecka K, Altamura S, Hentze MW, Muckenthaler MU. Bone morphogenetic protein
(BMP)-responsive elements located in the proximal and distal hepcidin promoter are critical for its response to
HJV/BMP/SMAD. J Mol Med DOI 10.1007/s00109-009-0447-2
14.
Powell LW. Primary iron overload. In: Brock JH, Halliday JW, Pippard MJ, Powell LW (Hrsg) Iron metabolism in
health and disease. Saunders, London 227-270
15.
Giardina PJ, Grady RW. Chelation therapy in betathalassemia: the benefits and limitations of desferrioxamine.
Semin Hematol 1995; 32: 304-312
16.
Fosburg M, Nathan D, Wayne A. Desferrioxamine provocative test: methodology for estimating iron and total iron
binding capacity Blood 1990; 76: 2162
17.
Aessopos A, Farmakis D, Hatziliami A, Fragodimitri C, Karabatsos F, Joussef J, Mitilineou E, Diamanti-Kandaraki
E, Meletis J, Karagiorga M. Cardiac status in well-treated patients with thalassemia major. Eur J Haematol 2004;
73: 359-366
18.
Hahn PF, Bale WF. Ross IF, Balfour WM, Whipple GH. Radioactive iron absorption by gastro-intestinal tract:
influence of anemia, anoxia, and antecedent feeding. J Exp Med 1943; 78:169-88
19.
Roe MA, Heath AM, Oyston SL, Macrow C, Hoogewerff JA, Foxall R, Dainty JR, Majsak-Newman G, Willis G,
Fairweather-Tait SJ. Iron absorption in male C282Y heterozygotes. Am J Clin Nutr 2005;81:814 –21
20.
Salonen JT, Nyyssonen K, Korpela H, Tuomilehto. J,. Seppanen. R,. Salonen R. High stored iron levels are
associated with excess risk of myocardial infarction in eastern Finnish men. Circulation 1992; 86(3):803-11
21.
Weinberg ED. The role of iron in cancer. Eur J Cancer Prev 1996; 5:19-36
22.
Gordeuk VR, Mukiibi J, Hasstedt SJ, Samowitz W, Edwards CQ, West G, Ndambire S, Emmanual J, Nkanza N,
Chapanduka Z, Randall M, Boone P, Romano P, Martell RW, Yamashita T, Effler P, Brittenham G. Iron overload in
Afrika. Interaction between a gene and dietary iron content. N Engl J Med 1992; 326:95-100
23.
Schümann K, Ettleb T, Szegnera B, Elsenhans B, Solomons NW. On risks and benefits of iron supplementation
recommendations for iron intake revisited. J Trace Elem Med Biol 2007; 21:147–168
24.
Singh M, Ashwell M, Sanderson P, Cade J, Moreton J, Fairweather-Tait S, Roe M, Marx JJ, Worwood M, Cook
JD. Risk of iron overload in carriers of genetic mutations associated with hereditary haemochromatosis: UK Food
Standards Agency workshop. Br J Nutr 2006; 96(4):770-3











© www.eiseninfo.de
Eisenüberladung
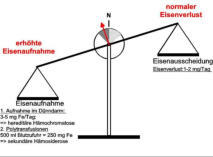
Definition von EisenüberladungUnsere westliche Mischkost-Nahrung enthält mit 6 mg
Fe/1.000 kcal relativ viel Eisen. Allerdings werden
daraus normalerweise nur 1-2 mg/Tag (10 % der
Eisenmenge), bei maximaler Hochregulation der
intestinalen Eisenabsorption z.B. im Eisenmangel ca. 3-
5 mg Eisen/Tag absorbiert. Eine nicht dem Bedarf
angepasste zu hohe Absorption von Nahrungseisen führt
auf mittlere und längere Sicht zu einer Eisenüberladung
vorwiegend in Parenchymzellen der Leber und
endokrinen Organen, da überschüssig aufgenommenes
Eisen nicht ausgeschieden werden kann (Abb. 1). Im
Normalzustand wird dies durch die Regulation der
intestinalen Eisenabsorption bei gefüllten
Eisenspeichern verhindert. In der Leber wird der
„Speicherregulator“ Hepcidin synthetisiert und die
Eisenabsorption dadurch herunterreguliert.

Eisenüberladung
Aderlasstherapie. Methode aus dem Mittelalter!? Für Eisenspeicherkrankheit aber hochmodernAbb. 1 Positive Eisenbilanz durch
erhöhte Nahrungseisenaufnahme
oder durch chronische
Bluttransfusionen.