



Messung der Lebereisenkonzentration mit dem Biomagnetomer
Die Kenntnis der Lebereisen-Konzentration erlaubt auch eine Abschätzung des Speichereisens wie Studien mit
erschöpfenden quantitativen Phlebotomien gezeigt haben. In b-Thalassämie-Patienten nach Knochenmarks-
Transplantation wurde die Relation (Gleichung 3) zwischen dem durch erschöpfende Phlebotomien bestimmten
Ganzkörper-Speichereisen (total body iron TBI [mg Fe]) und der gemessenen Lebereisen-Konzentration (LIC
[mg/gdry wgt]) von in Paraffin eingebetteten Biopsien unter Berücksichtigung des Körpergewichts (body weight
BW [kg]) erhalten (32). 
(3) 
TBI = 10.6 · LICdry wgt · BW
(Ganzkörper-Speichereisen)
Inwieweit sich diese Relation auf Patienten mit Eisenüberladung aufgrund akuter Bluttransfusionen übertragen
lässt, bleibt dahingestellt.
Biomagnetische Lebersuszeptometrie 
Die Möglichkeit, die magnetische in-vivo Suszeptometrie zur Messung des Lebereisens auszunutzen, wurde
erstmalig von Bauman & Harris (33) an eisenüberladenen Ratten aufgezeigt. Allerdings waren die technischen
Voraussetzungen zu der Zeit noch unzureichend. Ausreichend empfindliche SQUID-Magnetometer (SQUID =
Superconducting QUantum Interference Device) basierend auf dem quantenmechanischen Josephson Effekt
wurden erst später entwickelt. Im Falle der Biomagnetischen Leber-Suszeptometrie (BLS) ist die
Magnetisierung in Gleichung 3 direkt proportional zum angelegten Feld Bf und zur magnetischen Suszeptibilität
aller Atome pro Volumenelement, wobei eine mikroskopische Heterogenität der Atome keinen Einfluss auf den
Wert von c hat. Daraus ergibt sich das Suszeptometrie-Signal durch Integration über alle Volumenelemente dV
im Abstand r von der Detektorspule als 
(4)
DF = ∫ c(r) Bf(r)•Bd(r) dV
(Suszeptometrie-Signal)
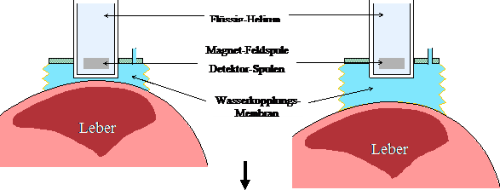
In der praktischen Realisierung der BLS wird meistens die Differenz-Methode benutzt (siehe Abbildung 4).
Dabei wird die Änderung der magnetischen Volumensuszeptibilität Dc zwischen Thorax und dem
Referenzmedium Wasser gemessen (34).
Abb. 4: Differenz-Methode zur Messung der Lebereisenkonzentration: Der Patient wird im Magnetfeld der
Startposition (links, 20-30 milliTesla) um ca. 5 – 10 cm (rechts, ca. 1 milliTesla) senkrecht nach unten bewegt.
Während dieses vertikalen Scans folgt die Wasserkopplungs-Membran dem Patienten und die Änderung des
magnetischen Flusses wird als Funktion des Abstandes in den Detektorspulen und SQUIDs gemessen.
Die Änderung der magnetischen Volumensuszeptibilität Dc wird durch das paramagnetische Ferritin- und
Hämosiderin-Eisen (cFe = 1600·10-6) und das Referenzmedium (Wasser) bestimmt, wobei die
diamagnetischen Eigenschaften von biologischem Körper-Gewebe und Wasser näherungsweise gleichgesetzt
werden können (c = -9·10-6) und um 3 Größenordnungen vom Ferritin-/Hämosiderin-Eisen übertroffen werden.
In erster Näherung kann daraus die Lebereisenkonzentration (LIC) bestimmt werden (6).
(5)
LIC = Dc / cFe
(spezifische magnetische Ferritin-Suszeptibilität)
Erstmalig wurde diese Methode gegen die Eisenkonzentrationen in Leberbiopsien von Patienten mit hereditärer
Hämochromatose validiert (35). Wie die Gleichungen 4 und 5 zeigen, ist keine Kalibrierung gegen
Leberbiopsien notwendig. Es erfolgt lediglich eine physikalische Kalibrierung gegen ein Objekt mit bekannter
magnetischer Suszeptibilität und definierter Geometrie (36). Insofern ist die BLS eine streng mathematisch-
physikalische Methode, wobei das Flussintegral für den der Verlauf des Mess-Signals (Gleichung 4.4) gegen
den Abstand genau berechnet werden kann.
Allerdings musste auch diese Methode mit biologischen Modellen (Eisenbestimmung in Leberbiopsien,
quantitative Phlebotomie) validiert werden (6, 35, 37). Diese Validierung ergab an 38 Patienten mit hereditärer
Hämochromatose (und Thalassämien) einen streng linearen Zusammenhang (r2 = 0.98) mit der
Eisenbestimmung in Feuchtgewichts-Biopsien (Atomabsorptions-Spektroskopie) im Bereich von 30 bis 5000
µg/gwet weight mit einem Regressionskoeffizienten von 1.00 ± 0.03, der damit die Richtigkeit der spezifischen
magnetischen Suszeptibilität des Hämosiderin-/Ferritin-Eisenkomplexes anzeigt (Gleichung 4).
Da bei Patienten mit Transfusions-Siderose 70 – 90% des Ganzkörper-Speichereisen in der Leber gespeichert
sind (15), lässt sich durch zusätzliche Messung des Lebervolumens das gesamte Lebereisen (u. U. zusätzlich
das Milzeisen) bestimmen. Unter der Annahme, dass das Leber- und Milzeisen 80% des Speichereisens
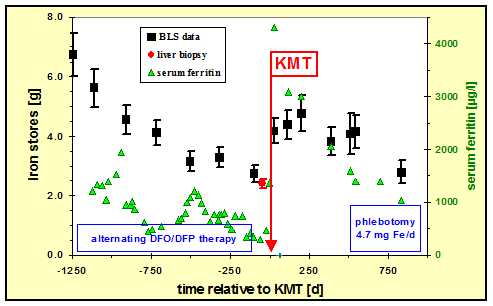
darstellt, kann daraus das Ganzkörper-Speichereisen (total body iron TBI) berechnet werden (9). In Abbildung 4
ist dies für eine typische Biosuszeptometrie-Indikation, die Messung der Eisenspeicher vor und nach
Knochenmark-Transplantation, dargestellt.
Abb. 4: Überwachung und Kontrolle der Eisenparameter in einem Patienten mit ß-Thalassaemia major vor und
nach Knochenmark-Transplantation (KMT). Der Verlauf des Eisenspeicherung wird gut durch die nichtinvasiven
Messungen des Lebereisens (BLS) widergegeben.
Literatur1. Brittenham GM, Badman DG. Noninvasive measurement of iron: report of an NIDDK workshop. Blood 2003; 101:15-19
2. Addison GM, Beamish MR, Hales CN, Hodgkins M, Jacobs A, Llewellin P. An immunoradiometric assay for ferritin in the
serum of normal subjects and patients with iron deficiency and iron overload. J Clin Pathol 1972; 25:326-9
3. Walters GO, Miller FM,Worwood M. Serum ferritin concentration and iron stores in normal subjects. J Clin Pathol 1973;
26:770-72
4. Cappellini MD, Cohen A, Piga A, Bejaoui M, Perrotta S, Agaoglu L, Aydinok Y, Kattamis A, Kilinc Y, Porter J, Capra M,
Galanello R, Fattoum S, Drelichman G, Magnano C, Verissimo M, Athanassiou-Metaxa M, Giardina P, Kourakli-Symeonidis A,
Janka-Schaub G, Coates T, Vermylen C, Olivieri N, Thuret I, Opitz H, Ressayre-Djaffer C, Marks P, Alberti D. A Phase III study of
deferasirox (ICL670), a once-daily oral iron chelator, in patients with b-thalassemia. Blood 2005; 107:3455-3462
5. Borgna-Pignatti C, Rugolotto S, De Stefano P, Zao H, Cappellini MD, Del Vecchio GC, Romeo MA, Forni GL, Gamberini
MR, Ghilardi R, Piga A, Cnaan A. Survival and complications in patients with thalassemia major treated with transfusion and
deferoxamine. Haematologica 2004; 89:1187-93
6. Fischer R, Farrell DE. Liver iron susceptometry. In: Andrä W, Nowak H (Eds.). Magnetism in Medicine - a Handbook, 2nd
Ed. Wiley-VCH, Berlin 2006 (in press)
7. Clark PR, St. Pierre TG. Quantitative mapping of transverse relaxivity (1/T2) in hepatic iron overload: a single spin-echo
imaging methodology. Magn Reson Imag 2000; 18:431-38
8. Anderson LJ, Holden S, Davis B, Prescott E, Charrier CC, Bunce NH, Firmin DN, Wonke B, Porter J, Walker JM, Pennell
DJ. Cardiovascular T2-star (T2*) magnetic resonance for the early diagnosis of myocardial iron overload. Eur Heart J 2001;
22:2171-79
9. Fischer R, Tiemann CD, Engelhardt R, Nielsen P, Dürken M, Gabbe EE, Janka GE. Assessment of iron stores in children
with transfusion siderosis by biomagnetic liver susceptometry. Am J Hematol 1999; 60:289-99
10. Nielsen P, Engelhardt R, Duerken M, Janka GE, Fischer R. Using SQUID biomagnetic liver susceptometry in the treatment
of thalassemia and other iron loading diseases. Transfus Sci 2000; 23:257-58
11. Nielsen P, Engelhardt R, Düllmann J, Fischer R. Noninvasive liver iron quantification by SQUID-biosusceptometry and serum
ferritin iron as new diagnostic parameters in hereditary hemochromatosis. Blood Cells Mol Dis 2002; 29:451–58
12. Nielsen P, Fischer R, Engelhardt R, Düllmann J. Diagnosis of hereditary haemochromatosis using non-invasive methods.
Transfus Med Hemother 2003; 30:27–36
13. Jensen PD, Jensen FT, Christensen T, Nielsen JL, Ellegaard J. Relationship between hepatocellular injury and transfusional
iron overload prior to and during iron chelation with desferrioxamine: a study in adult patients with acquired anemias. Blood 2003;
101:91–96
14. Dürken M, Nielsen P, Knobel S, Finckh B, Herrnring C, Dresow B, Kohlschütter B, Stockschlader M, Krüger WH,
Kohlschütter A, Zander AR. Nontransferrin-bound iron in serum of patients receiving bone marrow transplants. Free Radic Biol
Med 1997; 22:1159-63
15. Modell B, Berdoukas V. The clinical approach to thalassemia. London : Grune & Stratton , New York 1984
16. Guyader D, Gandon Y, Robert JY, Heautot JF, Jouanolle H, Jacquelinet C, Messner M, Deugnier Y, Brissot P. Magnetic
resonance imaging and assessment of liver iron content in genetic hemochromatosis. J Hepatol 1992; 15:304-8
17. Chatterton BE, Thomas CM, Schultz CG. Liver density measured by DEXA correlates with serum ferritin in patients with
beta-Thalassemia Major. J Clin Densitom 2003; 6:283-88
18. Wielopolski L, Zaino EC. Noninvasive in-vivo measurement of hepatic and cardiac iron. J Nucl Med 1992; 33:1278-82
19. Rinck PA. Magnetic Resonance in Medicine. The Basic Textbook of the European Magnetic Resonance Forum (EMRF).
ABW Wissenschaftsverlag GmbH , Berlin , 2003
20. Bravo A, Sheth SG, Chopra S. Current concepts: liver biopsy. N Engl J Med 2001; 344:495-500
21. Janes CH, Lindor KD. Outcome of patients hospitalized for complications after outpatient liver biopsy. Ann Int Med 1993;
118:96-98
22. Tan KT, Rajan DK, Kachura JR, Hayeems E, Simons ME, Ho CS. Pain after percutaneous liver biopsy for diffuse hepatic
disease: a randomized trial comparing subcostal and intercostals approaches. J Vasc Intervent Radiol 2005; 16:1215-19
23. Ludwig J, Batts KP, Moyer TP, Baldus WP, Fairbanks VF. Liver biopsy diagnosis of homozygous hemochromatosis: a
diagnostic algorithm. Mayo Clin Proc 1993; 68:263-267
24. Ambu R, Crisponi G, Sciot R, VanEyken P, Parodo G, Iannelli S, Marongiu F, Silvagni R, Nurchi V, Costa V, Faa G, Desmet
VJ. Uneven hepatic iron and phosphorous distribution in beta-thalassemia. J Hepatol 1995; 23:544-49
25. Barry M, Sherlock S. Measurement of liver-iron concentration in needle-biopsy specimens. Lancet 1971; 1:100-3
26. Butensky E, Fischer R, Hudes M, Schumacher L, Williams R, Moyer TP, Vichinsky E, Harmatz P. Variability in hepatic iron
concentration in percutaneous needle biopsy specimens from patients with transfusional hemosiderosis. Am J Clin Pathol 2005;
123:146-52
27. Olivieri NF , Brittenham GM. Iron-chelating therapy and the treatment of thalassemia. Blood 1997; 89:739-61
28. Ropert-Bouchet M, Turlin B, Graham G, Rabault B, Le Treut A, Brissot P, Loréal O, Alberti D, Deugnier Y. Drying methods
affect the wet:dry weight ratio of liver tissue samples and impact liver iron content (LIC) measurements. BioIron 2005, Prague ,
P274 (abstract)
29. Fischer R, Piga A, Harmatz P, Nielsen P. Monitoring long-term efficacy of iron chelation treatment with biomagnetic liver
susceptometry. Ann N Y Acad Sci 2005; 1054:350-57
30. Angelucci E, Muretto P, Nicolucci A, Baronciani D, Erer B, Gaziev J, Ripalti M, Sodani P, Tomassoni S, Visani G, Lucarelli G.
Effects of iron overload and hepatitis C virus positivity in determining progression of liver fibrosis in thalassemia following bone
marrow transplantation. Blood 2002; 100:17-21
31. Deugnier YM, Loreal O, Trulin B, Guyader D, Jouanolle H, Moirand B, Jacquelinet C, Brissot P. Liver pathology in genetic
hemochromatosis: a review of 135 homozygous cases and their bioclinical correlations. Gastroenterology 1992; 102:2050-59
32. Angelucci E, Brittenham GM, McLaren CE, Ripalti M, Baronciani D, Giardini C, Galimberti M, Polchi P, Lucarelli G. Hepatic
iron concentration and total body iron store in thalassemia major. N Engl J Med 2000; 343:327-31
33. Bauman JH, Harris JW. Estimation of hepatic iron stores by in vivo measurement of magnetic susceptibility. J Lab Clin Med
1967; 70:246-57
34. Farrell DE, Tripp JH, Zanzucchi PE, Harris JW, Brittenham GM, Muir WA. Magnetic measurement of human iron stores.
IEEE Trans Magn 1980; 16:818-23
35. Brittenham GM, Farrell DE, Harris JW, Feldmann ES, Danish EH, Muir WA, Tripp JH, Bellon EM. Magnetic susceptibility
measurement of human iron stores. N Eng J Med 1982; 307:1671-75
36. Paulson DN, Fagaly RL, Toussaint RM, Fischer R. Biomagnetic susceptometer with SQUID instrumentation. IEEE Trans
Magn 1991; 27:3249-52
37. Fischer R, Engelhardt R, Nielsen P, Gabbe EE, Heinrich HC, Schmiegel WH, Wurbs D. In: Hoke M, Erné SN, Okada YC,
Romani GL (Eds.). Advances in Biomagnetism '91, Liver iron quantification in the diagnosis and therapy control of iron overload
patients. Elsevier, Amsterdam 1992; 585-88












© www.eiseninfo.de
Diagnostik bei Eisenüberladung
Neben der physikalisch-chemischen Bestimmung der
Eisenkonzentration kann die Eisenverteilung in einem
histologischen Schnitt der Leber nach Anfärbung auch
semi-quantitativ beurteilt werden. Als weitgehend
standardisierte Methode ist das Beurteilungs-Schema
von Deugnier (31) anzusehen, das den Grad der
Eisenablagerung in Hepatozyten und Kupffer-Zellen auf
einer Skala von 0 bis 60 (total iron score TIS) bewertet.
Die quantitative Phlebotomie wird bei Patienten mit
hereditärer Hämochromatose seit langem zur Erfassung
des Gesamtspeichereisens eingesetzt. Eine
Schwierigkeit ist dabei die Bestimmung der relativ hohen
Absorptionsrate aus Nahrungseisen, die besonders
gegen Ende der Aderlasstherapie-Serie Eisen-
Absorptionsraten von bis zu 10 mg/d und mehr
annehmen kann. Dieses Modell eignet sich aber auch
dazu, um nicht-invasive Methoden zu validieren, wie der
Aderlässe mobilisierter Eisenmenge und der mittels
SQUID-Biosuszeptometrie bestimmten Lebereisen-
konzentration gezeigt hat (6).
.
Neben der physikalisch-chemischen Bestimmung der
Eisenkonzentration kann die Eisenverteilung in einem
histologischen Schnitt der Leber nach Anfärbung auch
semi-quantitativ beurteilt werden. Als weitgehend
standardisierte Methode ist das Beurteilungs-Schema
von Deugnier (31) anzusehen, das den Grad der
Eisenablagerung in Hepatozyten und Kupffer-Zellen auf
einer Skala von 0 bis 60 (total iron score TIS) bewertet. 
Die quantitative Phlebotomie wird bei Patienten mit
hereditärer Hämochromatose seit langem zur Erfassung
des Gesamtspeichereisens eingesetzt. Eine
Schwierigkeit ist dabei die Bestimmung der relativ hohen
Absorptionsrate aus Nahrungseisen, die besonders
gegen Ende der Aderlasstherapie-Serie Eisen-
Absorptionsraten von bis zu 10 mg/d und mehr
annehmen kann. Dieses Modell eignet sich aber auch
dazu, um nicht-invasive Methoden zu validieren, wie der
nachgewiesene lineare Zusammenhang zwischen durch
Aderlässe mobilisierter Eisenmenge und der mittels
SQUID-Biosuszeptometrie bestimmten Lebereisen-
konzentration gezeigt hat (6). 
. 

Eisenüberladung
Messung der Lebereisenkonzentration mit dem Hamburger Biomagnetomer





















