Abb. 1 Struktur von Deferipron (1,2 Dimethyl-3-hydroxypyridin-4-on; DFP) mit seinen zwei Bindungsstellen für Eisen.
3 Moleküle DFP sind notwendig, um ein Atom Fe vollständig zu komplexieren (3:1). Die bei zweizähnigen Chelaten
theoretisch mögliche Bildung von unvollständigen Chelaten (DFP:Fe = 2:1) wird als mögliche Ursache für einige der
beobachteten Nebenwirkungen von DFP diskutiert. 
Entwicklungs-Geschichte von DFP als Eisenchelator 
Die Entwicklungsgeschichte von DFP kann man mit Fug und Recht als außergewöhnlich bezeichnen, weil sie sehr
wechselhaft verlief, anfangs mehr von Einzelpersonen als von Pharmafirmen betrieben wurde, und weil sie von
erbittert geführten Konfrontationen in der Literatur und vor Gericht zwischen Befürwortern und Gegnern geprägt
wurden, die auch heute noch anhalten (4-6). Am Anfang stand G. Kontoghiorghes, der als Doktorand in einem
pharmakologischen Labor in London mit der Untersuchung von Hydroxypyridinonen als mögliche Eisenchelatoren
beauftragt war. Der erste untersuchte Vertreter, 1,2 Dimethyl-3-hydroxypyrid-4-on (CP20) und seine Synthese waren
schon lange bekannt. Er verließ das Labor mit der Begeisterung für DFP und hat in der Folgezeit versucht, DFP
möglichst schnell für Thalassämie-Patienten zur Verfügung zu stellen. Diese Aktivitäten führten die indische Firma
Cipla 1994 dazu, DFP als KelferTM in Indien registrieren lassen, was nur möglich war, weil Indien zu diesem
Zeitpunkt (aktuell gerade geändert) keinen Patentschutz für Importpräparate anerkannte. Fr. Dr. N. Olivieri in der
Kinderklinik Toronto begann zu dieser Zeit Studien mit DFP an b-Thalassämie-Patienten in Kanada durchzuführen.
Als DFP auf entsprechenden Konferenzen immer weiter für Aufmerksamkeit sorgte und Patientenorganisationen
aufmerksam wurden, hat Ciba-Geigy (heute Novartis) das schon einige Zeit bestehende Patent für DFP
übernommen, um diesen Chelator zur Zulassung zu bringen. Die diesbezüglichen Aktivitäten von CIBA fanden dann
aber, für Außenstehende etwas unerwartet, ein abruptes Ende und die nach einer Fusion neu gebildete Fa. Novartis
begann eine breit gefächerte Neuentwicklung für einen oralen Chelator, die 2006 zur weltweiten Zulassung von
ICL670 (Deferasirox, DSX) geführt hat. 
Das Patent für DFP wurde sofort von der kanadischen Firma Apotex übernommen, die anfangs mit Dr. Olivieri,
später gegen Ihren Widerstand, große Patientenstudien in Italien und USA durchgeführt und die 1999 Deferipron als
FerriproxTM zur Zulassung in Europa gebracht hat. DFP ist heute in 43 Ländern zugelassen, nicht aber in den USA
und Kanada. Dr. Olivieri warnt seit 1995 vor DFP, das sie für ineffektiv und hepatotoxisch hält (4). Inzwischen haben
sich die Befunde in Richtung einer DFP-spezifischen Leberschädigung als nicht reproduzierbar erwiesen und das
vermeintliche Risiko für Patienten unter DFP-Therapie hat sich evtl. sogar ins Gegenteil verkehrt, weil DFP aktuell
ein kardioprotektiver Effekt zugeschrieben wird, von dem Thalassämie-Patienten unter DFP-Therapie eher
profitieren würden (7). 
Viele weitere Derivate der Hydroxypyridinon-Reihe wurden inzwischen hergestellt und untersucht. Einige davon
zeigen eine viel stärkere Eisenbindung als DFP, können aber offenbar wegen toxischer Reaktionen nicht am
Menschen eingesetzt werden (8). Nach Angaben der Fa. Apotex befinden sich einige aussichtsreiche Vertreter der
Hydroxypyridinone in präklinische Testungen (z.B. CP363, CP502) (9). Es bleibt abzuwarten, ob daraus ein
verbessertes Nachfolgepräparat entsteht. 
Pharmakokinetik, Eisenexkretion 
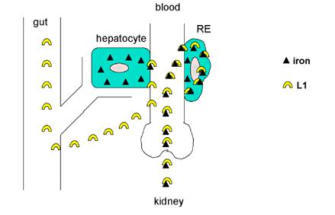
Deferipron als kleines neutrales Molekül kann theoretisch besser die Zellmembran permeiren und in der Zelle Eisen
binden als das vergleichsweise höhermolekulare Deferoxamin (Abb. 2.) (10). Dies ist in der Praxis auch ausführlich
an Erythrozyten von Normalpersonen, bzw. von Thalassämie oder Sichelzellpatienten gezeigt worden (11). 
Abb. 2: Urin-Eisenausscheidung bei DFP-Therapie. DFP ist keliner (MW 139) und lipophiler als DFO (MW 559) und
kann intrazelluläres Eisen besser erreichen und abtransportieren (modifiziert nach 10)
Deferipron wird bereits im Magen absorbiert. Im Plasma ist ein Peak nach 45-60 min zu messen. Gleichzeitige
Nahrungsaufnahme reduziert die Aufnahmegeschwindigkeit, nicht aber die aufgenommene Menge (12). DFP und
sein Eisenchelat werden über den Urin ausgeschieden, eine fäkale Eisenausscheidung ist offenbar
vernachlässigbar gering (13). Leider ist die notwendige Dosis, die einen typischen Patienten mit chronischer
Transfusionssiderose auf Dauer in negativer Eisen-Bilanz halten kann vergleichsweise hoch. Ursache dafür ist der
extensive Metabolismus in der Leber. Die 3-Hydroxyl-Funktion, die funktionell unentbehrlich ist für die
Eisenkomplexierung, ist auch primäres Ziel für die Glucuronidierung. Wiederfindungsstudien bei Ratten und
Menschen haben 44 % bzw. 85 % der applizierten Dosis als nicht eisenbindendes 3-O-glucoronidiertes Konjugat im
Urin wiedergefunden (14). Die Fläche unter der Kurve für die Konzentration von DFP im Plasma variiert erheblich
zwischen verschiedenen Patienten, was offenbar die stark variierende Wirksamkeit eine DFP-Therapie erklären
kann. 
Eisenbilanz-Studien an 13 Patienten zeigten, dass die Gesamt-Eisenausscheidung nach 75 mg/kg DFP 62 % der
Menge entsprachen, die nach 60 mg/kg DFO s.c über 8 h insgesamt ausgeschieden wurden (15). 
Dosierung und Wirksamkeit
Die Wirksamkeit einer DFP-Therapie wurde in einer ganzen Reihe von Studien untersucht, z.B. durch die
Eisenausscheidung in den 24 h-Urin nach Gabe von DFP, sowie in Langzeitstudien durch Verlaufskontrollen von
Parametern wie Serum-Ferritin und Leber-Eisen (Tabelle 1). Anders als bei Deferoxamin wird die Wirksamkeit von
DFP nicht durch gleichzeitige Gabe von Vitamin C verbessert. 
Methode 
Ergebnis
Referenz 
24-h-Fe-Urin-Exkretion
21-42 mg/d
16,17 
Serum-Ferritin (basal > 4000 µg/l) 
signifikante Abnahme
18, 19 
Serum-Ferritin (basal ca. 2000 µg/l) 
keine signifikante Abnahme
20, 21 
Leber-Eisen
Abnahme
19, 22 
Leber-Eisen
Zunahme
23, 24 
Tab.1.: Beurteilung der Chelator-Effektivität durch eine Deferipron-Standarddosis (75 mg/kg) in
Thalassämiepatienten beurteilt anhand verschiedener Kriterien.
Eine signifikante Abnahme der Serum-Ferritin-Werte zeigte sich vor allem bei vorher nicht ausreichend chelierten
Patienten mit entsprechend hohen Basalwerten. Bei vorher gut therapierten Patienten zeigte sich dagegen in den
meisten Studien keine signifikante Veränderung der Ferritinwerte oder der Lebereisenkonzentrationen. In einigen
Patienten kommt es sogar zu einer Zunahme der bestehenden Eisenüberladung.
In einer Studie aus Hamburg und Turin an 54 Patienten mit ß-Thalassaemia major, die alle gut vorbehandelt waren, 
kam es nach 48.5 Monaten einer DFP-Therapie (70 mg/kg/d) im Mittel zu einem Anstieg von Serum-Ferritin (1897
auf 2519 µg/l) und Leber-Eisen (SQUID-Methode: 1456 auf 3064 µg/g) (24). In einer Gruppe von Patienten gleichen
Alters kam es unter fortgesetzter DFO-Therapie im Beobachtungszeitraum von 23 Monaten ebenfalls zu einem
Anstieg der mittleren Werte (Ferritin: 1422 auf 1631 µg/l, Lebereisen: 1076 auf 1260 µg/g). Bei 67 % der Patienten
wurde eine gleich gute Ausscheidung von Eisen aus dem Gesamtkörper festgestellt wie unter der Standard-DFO-
Therapie, während die Lebereisenkonzentration in 72 % der Fälle anstieg. Dies erklärt sich rechnerisch durch den
Anstieg des transfundierten Eisens bedingt durch die Gewichtszunahme im Wachstum der noch jungen Patienten
(n=54, Alter 7-22 Jahre).In dieser Studie war mit einer Standarddosis von 75 mg/kg/d DFP der Großteil der ß-
Thalassaemia major-Patienten gerade ausreichend dosiert, um auf Dauer eine ausgeglichene oder negative
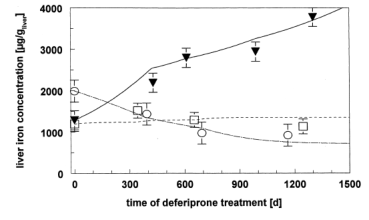
Eisenbilanz zu halten. Abb. 3 zeigt den Verlauf der Lebereisenkonzentration bei drei typischen Fällen mit positver
oder negativer Eisenbilanz.. 
Diese Studie zeigt auch auf, dass das Serum-Ferritin als diagnostischer Parameter für die Verlaufskontrolle nur ein
qualitativer Anhalt sein kann und zur genauen Analyse der Wirksamkeit eines Eisenchelators nicht ausreichend ist. 
Abb. 3.: Lebereisenkonzentration bei drei typischen Patienten mit ß-Thalassämie unter DFP-Therapie über 4
Jahren mit stabiler, negativer oder positiver Eisenbilanz. Die Kurven zeigen Modellberechnungen unter
Berücksichtigung der initialen Eisenspeicher, der transfundierten Eisenmengen und der Chelator-Dosis-Raten (nach
24) 
In den Fällen, die mit 75 mg/kg/d DFP auf Dauer nicht ausreichend therapiert werden können, empfiehlt Hoffbrand
eine höhere Dosierungen (100 mg/kg) oder eine Kombinationstherapie mit DFO (25).
DFP und Herzeisen
Den ersten Hinweis auf eine spezifische Wirkung von DFP auf die Herzeisenkonzentration stammt aus dem Jahre
1995 (26). Danach ergab sich bei DFP-, nicht aber bei DFO-behandelten ß-Thalassämie-Patienten in der
Kernspintomographie Verlängerung der T2-Relaxationszeit für den Herzmuskel als Zeichen der Reduktion der
Eisenkonzentration im Herzen. Dieser Befund ist bei dem damaligen Stand der MRI-Technik in Krankenhäusern
methodisch als eher zweifelhaft einzustufen. Aktuelle Studien mit der in Kapitel 4 beschriebenen MRI-T2*-Methode
scheinen besser geeignet zu sein, denn die sogenannte T2*-Relaxationszeit weist paramagnetisches Eisen
wesentlich sensitiver als frühere MRI-Methoden nach und korreliert offenbar mit der klinisch befundeten
ventrikulären Dysfunktion bei eisenüberladenen Thalassämie-Patienten. Eine kurze T2*-Relaxationszeit spricht für
eine höhere Eisenkonzentration im Herzmuskel und damit für ein kardiologisches Risiko (27-29). In einer Studie an
Patienten unter DFP und DFO-Therapie zeigte sich ein signifikanter Unterscheid in den T2*-Zeiten im Herzmuskel,
die DFP-Gruppe hatte signifikant längere T2*-Zeiten als die DFO behandelte Gruppe, während die DFO-Gruppe
länger T2*-Zeiten für Lebergewebe aufwiesen. (28). Es sei daran erinnert, dass eine kardiale Problematik
(Herzversagen, Rhythmusstörungen) eine häufige Todesursache bei Thalassämie-Patienten darstellt, sodass einem
solchen Therapieeffekt eine wichtige klinische Bedeutung zukommen würde. 
Diese Befunde werden unterstützt durch die retrospektive Auswertung von Langzeitüberlebensdaten von
Thalassämiepatienten. In einer Auswertung an Patienten aus Turin/Italien über 6 Jahren wurde die Verschlechterung
einer bestehenden kardialen Dysfunktion oder das Auftreten von neuen Befunden verfolgt (30). Am Ende zeigten 2
(4 %) der mit DFP behandelten Patienten (n=54) eine kardiale Verschlechterung gegenüber 15 (20 %) aus der
DFO-Gruppe (n=75). 
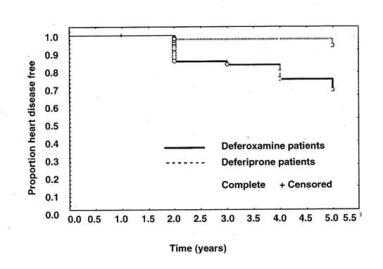
Eine Kaplan-Meier-Analyse der komplikationslosen 5-Jahreszeit einer Herzbeteiligung zeigte für die DFP-Gruppe
einen signifikanten Vorteil (p=0.003) (Abb. 4). 
Abb. 4: Kaplan-Meier Analyse der Herzkomplikations-freien Zeit in ß-Thalassämie-Patienten unter DFP oder DFO-
Therapie. 4 % gegenüber 20 % der Patienten (p=0.003) entwickelten eine kardiale Symptomatik. Dies spricht für
eine kardioprotektive Wirkung von DFP (nach 30). 
Kein Patient aus der DFP-Gruppe starb in dieser Zeit, während 3 Patienten aus der DFO-behandelten Gruppe an
Herzproblemen verstarben. 
Diese Ergebnisse wurden Dez. 2005 durch eine größere Auswertung bestätigt. 3610 italienischen Patienten aus 7
Zentren (Geburtsdatum 1970-1993, bis Jan. 1995 keine kardiale Komplikation befundet) wurden bis Dez. 2003
verfolgt (31). Bei Start waren beide Studiengruppen gleich bezüglich Alter und Geschlecht der Patienten. Die DFP-
Gruppe wies allerdings höhere Ferritinwerte auf. 359 Patienten erhielten DFO (3610 Patientenjahre), 157 Patienten
erhielten ausschließlich DFP (750 Patientenjahre). In der DFO-Gruppe wurden 52 kardiale Ereignisse, definiert als
befundeter Bedarf für eine ionotrope oder antiarrhythmische Medikation, inkl. 10 Todesfälle erfasst. In der DFP-
Gruppe kam es zu keinen (!) kardialen Ereignissen. 
In einer aktuellen prospektiven Studie über ein Jahr wurden 61 Patienten mit ß-Thalassaemia major, die vorher alle
mit DFO behandelt wurden, randomisiert weiter mit DFO (n=32, Dosis 43 mg/kg über 5.7 Tage/Woche) oder mit DFP
(n=29, Dosis 92 mg/kg/Tag) behandelt (32). Analysiert wurde die Veränderung der MRI-T2* Zeit, die als Maß für das
gefährliche myocardiale Speichereisen gilt. Die myocardiale T2*-Zeit stieg in der DFP-Gruppe signifikant höher als in
der DFO-Gruppe an (27 % gegenüber 13 %, p=0.023). Parallel dazu verbesserte sich die linksventrikuläre-
Ausstoßfraktion in der DFP-Gruppe mehr als in der DFO-Gruppe (3.1 % vs 0.3 %, p=0.003). 
Diese wichtigen Befunde deuten eindrucksvoll auf einen möglichen kardioprotektiven Effekt von DFP hin, insgesamt
kann dieser aber aus den vorwiegend retrospektiven Befunden nicht als abschließend gesichert gelten. Viele Fragen
sind vorerst offen, beispielsweise ist unklar, was die T2*-Technik auf molekularer Ebene eigentlich nachweist.
Unbestritten ist auch, dass Desferal seine kardioprotektive Wirkung für Patienten bereits eindeutig bewiesen hat
(33). So wird DFO z.B. in der Standardintervention-Therapie bei Patienten mit akutem lebensbedrohlichem
Herzversagen im Rahmen einer 24h-i.v.-DFO-Therapie eingesetzt, die eindrucksvolle Therapieerfolge nachweisen
kann (34). Es bleibt also z.B. zu klären, ob DFO per se schlechter kardial wirksam ist oder ob nur eine mangelnde
Compliance unter DFO-Therapie für diesen Effekt verantwortlich ist? Diese Frage mag epidemiologisch ohne Belang
sein, ist aber für einen Patienten unter einer gut durchgeführter DFO Therapie entscheidend wichtig. Unklar ist
auch, ob der DFP-Kardio-Effekt nur für Thalassämie gilt oder für alle Transfusionssiderosen?
Es sind deshalb randomisierte, kontrollierte prospektive Langzeit-Studien notwendig, um eine Überlegenheit von
DFP zweifelsfrei zu dokumentieren (35). 
Nebenwirkungen
Eine Agranulozytose (Neutrophilenzahl zwischen 0.0-0.5*109/L) ist die anerkannt wichtigste und schwerste
Nebenwirkung bei einer Therapie mit Deferipron. In einer speziellen Studie zur Häufigkeit dieser Nebenwirkung
wurden wöchentliche Blutproben untersucht. Eine Agranulozytose entwickelte sich in 0.5 % der Patienten während
eines Jahres mit einer Inzidenz von 0.6 per 100 Patientenjahren (21). Eine milde Neutropenie (Neutrophilenzahl
zwischen 0.5-1.5*109/L) trat in 4.8 % der Patienten auf. In einer anderen Studie an 532 Patienten mit Thalassämie
wurde die Inzidenz für Agranulozytose und milde Neutropenie 0.43. bzw. 2.08 per 100 Patientenjahren (36). Die
Agranulozytosen waren reversible nach Absetzen der Therapie, in einigen Fällen war die Gabe von „granulocyte-
colony-stimulating-factor“ (G-CSF) notwendig. 
Als häufig auftretende Nebenwirkungen werden gastrointestinale Beschwerden (ca. 20 %: Übelkeit, Erbrechen),
Arthralgien (13 %: Gelenkschmerzen, Muskelversteifung) und Zinkmangel benannt. (21). Die Arthralgien betrafen
besonders große Gelenke wie das Kniegelenk, traten aber wesentlich häufiger in indischen (20 %) als in
europäischen Patienten auf (3.7 %) und sind reversible nach Absetzen des Chelators. 
Eine Fluktuation von Leberindikatorenzymen (ALT), eine meist transiente Erhöhung ist unter DFP-Therapie aus
mehreren Studien bekannt. Dies kommt bei Thalassämiepatienten aber auch ohne Chelattherapie bzw. mit anderen
Chelatoren vor. Eine angebliche chronische Hepatotoxizität war Anlass für die bereits erwähnte heftige Konfrontation
in der Literatur um Risken und Nutzen von DFP. Ausgangspunkt war der Bericht über die Induktion und Progression
einer Leberfibrose unter DFP-Therapie, der zu einer im Wissenschaftsalltag eher ungewöhnlichen externen
Überprüfung und Neubefundung der Leberbiopsieproben aus dieser Studie geführt hat (4-6). Außerdem wurden in
der Folgezeit weitere Studien zu dieser Frage durchgeführt. In der ausführlichsten Studie an 56 Patienten über 3.5
Jahren wurden insgesamt 112 Leberbiopsieproben ausgewertet, wobei sich kein hepatotoxischer Effekt von DFP
nachweisen ließ, der zu einer Veränderung eines Leberfibrose-Scores geführt hat (37). 
Literatur
1.
Hider RC, Kontoghiorghes G, Silver J, Stockham MA. Pharmaceutically active hydroxypyridones.
1984. GB patent 21-46989 
2.
Kontoghiorges GJ, Aldouri MA, Sheppard L, Hoffbrand AV. 1-2-Dimethyl-3-hydroxypyrid-4-one, an
orally active chelator for treatment of iron overload. Lancet 1987; 1:1294-1295 
3.
Hider RC, Liu ZD. Emerging understanding of the advantage of small molecules such as
hydroxypyridinones in the treatment of iron overload. Curr Med Chem 2003; 10:1051-1064 
4.
Olivieri NF, Brittenham GM, McLaren CE, Tampleton DM, Cameron RG, McClellan RA, Burt AD,
Fleming KA. Long-term safety and effectiveness of iron-chelation therapy with deferiprone for
thalassemia major. N Eng J Med 1998; 339:417-423
5.
Tricta F, Spino M, Callea F, Nathan DG, Weatherall DJ, Stella M., Pinzello G, Maggio A, Wonke B,
Telfer P, Hoffbrand A, Grady RW, Giardina PJ, Cohen A. R., Martin M. B., Brittenham GM, Fleming KA,
Templeton DM, Olivieri NF, Kowdley KV, Kaplan MM. Iron Chelation with Oral Deferiprone in Patients
with Thalassemia. N Engl J Med 1998; 339:1710-1714 
6.
Brittenham GM, Nathan DG, Olivieri NF, Porter JB, Pippard M, Vichinsky EP, Weatherall DJ. 
Deferiprone and hepatic fibrosis. Blood 2003; 101:5089-5090
7.
Savulescu J. Thalassaemia major: the murky story of deferiprone. BMJ 2004; 328(7436):358-359 
8.
Smith AG, Clothier B, Francis JE, Gibbs AH, De Matteis F, Hider RC. Protoporphyria Induced by the
Orally Active Iron Chelator 1,2-diethyl-3-hydroxypyridin-4-one in C57BL/10ScSn Mice. Blood 1997;
89:1045-1051
9.
Huang X-P, Spino M, Thiessen JJ. Transport Kinetics of Iron Chelators and Their Chelates in Caco-2
Cells. Pharm Res 2006; 23: 280-290
10.
Hershko C, Link G, Konijin AM, Cabantchik ZI. Objectives and Mechanism of Iron Chelation Therapy.
Ann NY Acad Sci 2005; 1054:124-135 
11.
Shalev O, Repka T, Goldfarb A Grinberg L, Abrahamov A, Olivieri NF, Rachmilewitz EA, Hebbel RP.
Deferiprone (L1) chelates pathologic iron deposits from membranes of intact thalassaemic and sickle
red blood cells from both in vitro and in vivo. Blood 1995; 86:2008–2013 
12.
Matsui D, Klein J, Hermann C, Grunau V, McClelland R, Chung D, St-Louis P, Olivieri N, Koren G.
Relationship between the pharmacokinetics and iron excretion pharmacodynamics of the new oral iron
chelators 1,2-dimethyl-3-hydroxypyrid-4-1 in patients with thalassemia. Clin Pharmacol Ther 1991;
50:294-298
13.
Kontoghiorghes GJ, Bartlett AN, Hoffbrand AV, Goddard JG, Sheppard L, Barr J, Nortey P. Long-term
trial with the oral iron chelator 1,2-dimethyl-3-hydroxypyrid-4-one (L1), I: iron chelation and metabolic
studies. Br J Haematol. 1990; 76:295-300 
14.
Singh S, Epemolu O, Dobbin PS, Tilbrook GS, Ellis BL, Damani LA, Hider RC. Urinary metabolic
profiles in human and rat of 1,2-dimethyl and 1,2-diethyl-3-hydroxypyrid-4-1. iron chelator 1,2-dimethyl-
3-hydroxypyrid-4-1 or deferoxamine. Drug Metabol Dispo 1992; 20:256-261 
15.
Grady RW, Berdoukas V, Rachmilewitz EA. Iron chelation therapy: metabolic aspects of combining
deferiprone and deferoxamine [abstract]. 11th International Conference on Oral Chelation in the
Treatment of Thalassaemia Major and Other Diseases. Catania , Italy : 2001;74-78 
16.
Kersten MJ, Lange R, Smeets MEP, Vreugdenhil G, Roozendaal KJ, Lameijer W, Goudsmit R.
Longterm treatment of transfusional iron overload with the oral iron chelator deferiprone (L1): a Dutch
multicenter trial. Ann Hematol 1996; 73:247-252 
17.
Agarwal MB, Gupte SS, Viswanathan C, Vasandani D, Ramanathan J, Desai N, Puniyani RR,
Chhablani AT. Long-term assessment of efficacy and safety of L1, an oral iron chelator, in transfusion-
dependent thalassaemia: Indian trial. Br J Haematol 1992; 82:460-466
18.
Al-Refaie FN, Wonke B, Hoffbrand AV, Wickens DG, Nortey P, Kontoghiorghes GJ. Efficacy and
possible adverse effects of the oral iron chelator 1,2-dimethyl-3-hydroxypyrid-4-1 (L1) in thalassemia
major. Blood. 1992; 80:593-599 
19.
Olivieri NF, Brittenham GM, Matsui D, Berkovitch M, Blendis LM, Cameron RG, McClelland RA, Liu PP,
Templeton DM, Koren G. Iron chelation therapy with oral deferiprone in patients with thalassemia
major. N Engl J Med 1995;332:918-922 
20.
Hoffbrand AV, Al-Refaie F, Davis B, Siritanakatkul N, Jackson BFA, Cochrane J, Prescott E, Wonke B.
Longterm trial of deferiprone in 51 transfusion dependent iron overloaded patients. Blood 1998;
91:295-300
21.
Cohen AR, Galanello R, Piga A, DiPalma A, Vullo C, Tricta F. Safety profile of the oral iron chelators
deferiprone: a multicenter study. Br J Haematol 2000; 108:305-312 
22.
Del Vecchio GC, Crollo E, Schettini F, Schettini F, Fischer R, De Mattia D. Factors influencing
effectiveness of deferiprone in a thalassaemia major clinical setting. Acta Haematol 2000; 104:99-102
23.
Olivieri NF, Brittenham GM. Final results of the randomized trial of deferiprone (L1) and deferoxamine
(DFO) [abstract]. Blood 1997;90:264 
24.
Fischer R, Longo F, Nielsen P, Engelhardt R, Hider RC, Piga A. Monitoring long-term efficacy of iron
chelation therapy by deferiprone and desferrioxamine in patients with ß-thalassaemia major:
application of SQUID biomagnetic liver susceptometry. British Journal of Haematology 2003;
121:938–948
25.
Hoffbrand AV, Cohen A, Hershko C. Role of deferiprone in chelation therapy for transfusional iron
overload. Blood 2003; 102:17-23 
26.
Olivieri NF, Nathan DG, MacMillan JH Wayne AS, Liu PP, McGee A, Martin M, Koren G, Cohen AR.
Survival in medically treated patients with homozygous b-thalassemia. N Eng J Med 1994;
331:574–578
27.
Anderson L, Holden S, Davis B, Prescott E, Charrier CC, Bunce NH, Firmin DN, Wonke B, Porter J,
Walker JM, Pennell DJ. Cardiovascular T2-star (T2*) magnetic resonance for the early diagnosis of
myocardial iron overload. Eur Heart J 2001; 22:2171-2179 
28.
Pennell DJ, Bland JM. Deferiprone versus desferrioxamine in thalassaemia and T2* validation and
utility. Lancet 2003; 361:183-184 
29.
Anderson LJ, Wonke N, Prescott E, Holden S, Malcolm Walker J, Pennell DJ
30.
Comparison of effects of oral deferiprone and subcutaneous desferrioxamine on myocardial iron
concentrations and ventricular function in beta-thalassaemia. Lancet 2002; 360:516-520 
31.
Piga A, Gaglioti C, Fogliacco E, Tricta F. Comparative effects of deferiprone and deferoxamine on
survival and cardiac disease in patients with thalassemia major. Haematologica 2003; 70:489–496
32.
Borgna-Pignatti C, Cappellini MD, De Stefano P, Carlo Del Vecchio G, Forni GL, Gamberoni MR,
Ghilardi R, Piga A, Romeo MA, Zhao H, Cnaan A. Cardiac morbidity and mortality in deferoxamine- or
deferiprone-treated patients with thalassemia major. Cardiac morbidity and therapy in thalassemia
major. Blood 2006; 107:3733-3737
33.
Pennell DJ, Berdoukas V, Karagiorga M, Ladis V, Piga A, Aessopos A, Gotsis ED, Tanner MA, Smith
GC, Westwood MA, Wonke B, Galanello R. Randomized controlled trial of deferiprone or deferoxamine
in beta-thalassemia major patients with asymptomatic myocardial siderosis Blood 2006; 107:3738 -
3744
34.
Zurlo MG, De Stefano P, Borgna-Pignatti C, Di Palma A, Piga A, Melevendi C, Di Gregorio F, Burattini
MG, Terzoli S.Survival and causes of death in thalassaemia major. Lancet. 1989; 2:27-30 
35.
Davies BA, Porter JB. Long-term outcome of continuous 24-hour deferoxamine infusion via indwelling
intravenous catheters in high-risk beta-thalassemia. Blood 2000; 95:1229–1236
36.
Piga A, Roggero S, Vinciguerra T, Saccetti L, Gallo V, Longo F. Deferiprone: New Insight . Ann NY
Acad Sci 2005; 1054:169–174 
37.
Ceci A, Baiardi P, Felisi M, Carnelli V, De Sanctis V, Galanello R, Maggio A, Masera G, Piga A,
Schettini F, Stefano I, Tricta F. The safety and effectiveness of deferiprone in a large-scale, 3-year
study in Italian patients. Br J Haematol. 2002; 118:330-336 
38.
Wanless IR, Sweeney G, Dhillon AP, Guido M, Piga A, Galanello R, Gamberoni MR, Schwartz E, 
Cohen AR. Lack of progressive hepatic fibrosis during long-term therapy with deferiprone in subjects
with transfusion-dependent beta-thalassemia. Blood 2002; 100:1566-1569




Eisenchelatortherapie
Eine orale Eisenchelatortherapie ist möglich mit Deferipron (Handelsname: FerriproxR)










© www.eiseninfo.de
Therapie mit Deferiprone
Deferipron (DFP, CP20, L1,) ist ein einfacher Vertreter
der 3-Hydroxypyridin-4-One, die über die beiden
vicinalen Sauerstoffatome neutrale 3:1 Komplexe mit
Eisen(III) bilden können (Abb. 1) (1-3). Deferipron ist
der erste zugelassene oral zu verwendende
Deferipron (DFP, CP20, L1,) ist ein einfacher Vertreter
der 3-Hydroxypyridin-4-One, die über die beiden
vicinalen Sauerstoffatome neutrale 3:1 Komplexe mit
Eisen(III) bilden können (Abb. 1) (1-3). Deferipron ist
der erste zugelassene oral zu verwendende
Eisenchelator.