Nach der Einführung von DFO im Jahre 1962 lieferten die ersten Studien an Patienten mit einer intramuskulären
Applikation eher enttäuschende Ergebnisse, weil wegen zu geringer Wirksamkeit keine negative Eisenbilanz in
Patienten mit chronischem Transfusionsbedarf herzustellen war (1). Eine kontinuierliche i.v. und besonders die s.c.-
Infusion über 8-12 Stdn. erwiesen sich dagegen als wirksam. Es liegen mit Desferal inzwischen viele Daten vor und
es ist klar, dass Desferal das Leben von Patienten unter chronischer Transfusionstherapie deutlich verlängern kann
(2-4). Während unbehandelte Patienten mit b-Thalassämie in jungen Jahren versterben, nähern sich die neuesten
Überlebenskurven denen der Normalbevölkerung an. Epidemiologisch gesehen ist daher momentan das
Geburtsdatum entscheidend für den Therapieerfolg. In einer aktuellen Studie aus Italien wiesen Patienten, die bereits
1970 behandelt wurden, eine deutlich schlechtere Prognose auf als Patienten, die nach 1985 behandelt wurden (4).
Dies spricht eindeutig für die Verbesserung der Lebenserwartung durch eine moderne Chelattherapie. Allerdings ist
die Qualität der Behandlung von solchen Patienten europaweit sehr unterschiedlich, je nach Standard der einzelnen
Zentren. Eine Überblick über die Situation der b-Thalassämie in Deuschland gibt die Studie von Cario et al. (5).
Anwendung und praktische Handhabung
Die lebenslange Eisenchelator-Therapie mit Deferoxamin als tägliche, subkutane Übernacht-Infusionen ist eine
enorme Aufgabe und Belastung für die Patienten und die betroffenen Familien und erfordert äußerste Disziplin und
Organisation des täglichen Lebens.. Der Patient empfindet die Deferoxamin-Therapie als den am meisten
belastenden und schwierigsten Teil der Therapie. Die Transfusionen sind meist gut verträglich.
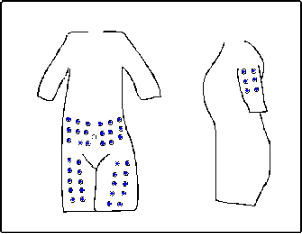
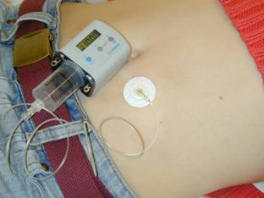
Als Injektionsorte eignen sich die Bauchhaut, Oberschenkel oder auch Oberarm (Abb. 2). Es ist wichtig die
Injektionsstelle täglich zu wechseln, damit sich dieser Hautbereich „erholen“ kann. Erfahrungsgemäß haben die
Patienten, die immer in die gleichen verhärteten Hautbereiche stechen, häufiger Probleme mit der Injektion.
Abb. 2: Wechselnde Injektionsstellen für die subkutane DFO-Therapie
Die Injektionssysteme sind heute sehr fein, sodass der Einstich selbst kaum weh tut. Abb. 6.3 zeigt eine
angeschlossene subkutane DFO-Injektion mit einer modernen kleinen Injektions-Pumpe. Verschiedene Pumpentypen
stehen für die Verabreichung zur Verfügung. Kleine, leise laufende Pumpen haben den Vorteil, dass sie auch während
der Schule, Ausbildung bzw. Arbeit am Körper getragen werden können und somit einen flexibleren Einsatz erlauben.
Abb. 3: Links: Durchführung einer s.c. DFO-Therapie bei einer jugendlichen Patientin mit b-Thalassämie. Rechts:
Typisches feines Injektionssystem mit Pumpe.
Die Infusionen können schmerzhaft sein und verursachen bei vielen Patienten Hautirritationen mit Juckreiz,
Schmerzen und Rötungen. Gelegentlich treten auch lokale allergische Hautreaktionen auf, die einige Tage anhalten
können. Höhere Verdünnungen, langsamere Infusionsgeschwindigkeiten, die Verwendung von
Lokalanästhetikahaltigen Cremes, Antihistaminika und in schweren Fällen auch Zusatz von Kortisonpräparaten zur
DFO-Infusion können helfen.
Vor dem 3. Lebensjahr tolerieren nur wenige Kinder das abendliche Anlegen der subkutanen Infusion. Je nach
Lebensalter des Patienten ergeben sich individuelle, alltägliche Schwierigkeiten und „organisatorische“ Probleme. Für
kleine Kinder z.B. ist das Tragen der Pumpe ein Hindernis beim Spielen und Toben und der Juckreiz an der
Injektionsstelle führt häufig dazu, dass das kleine Kind die Injektionsnadel nachts aus Versehen beim Kratzen
herausreißt und/oder unruhig schläft. Weiterhin versteht das Kind den Sinn der Infusionen noch nicht. Das Anlegen
der „Pumpe“ ist oft ein Drama für Eltern und Kind.
In der Pubertät wird häufig erstmals die lebenslange Erkrankung als Last wahrgenommen und die DFO-Therapie
vernachlässigt. Es kommt die Angst dazu, dass Freunde und Schulkameraden entdecken „was mit einem los ist“ und
das man eventuell gehänselt oder ausgeschlossen wird. Auch empfinden viele Jugendliche es schwer mit der Pumpe
auszugehen oder an Klassenfahrten teilzunehmen. Gerade in dieser Zeit der Ablösung vom Elternhaus muß ein
vertrauensvoller Arzt-Patientenkontakt bestehen und häufig muß der Arzt gemeinsam mit dem Patienten
Kompromisse finden um die DFO-Therapie mit dem täglichen Leben zu vereinbaren.
Viel muss vom Patienten oder den Eltern bedacht werden: „Wenn ich in den Urlaub fahre, auf eine Klassenreise oder
auf einen Schüleraustausch mitfahre, muss ich meinen Eisenchelator dann nehmen? Bekommt man in einem fremden
Land alle anderen nötigen Utensilien (Pflaster, Nadeln, Desinfektionsmittel, Spritzen zum Aufziehen des
Medikaments, sterile Tupfer…) oder muss man alles von zu Hause mitnehmen? Ist immer Kühlung für die
Medikamente vorhanden?“
Bei dem jungen Erwachsenen kommen Fragen über die Arbeit und oder das Studium dazu: Welche Arbeit kann später
ausgeübt werden, ohne dass die Pumpe hinderlich ist und die Therapie vernachlässigt wird? Kann man überall
studieren gehen und sicher sein, dass eine optimale Überwachung der Therapie gewährleistet ist? Bekomme ich
einen Ausbildungsplatz trotz meiner Erkrankung?
All diese Beispiele zeigen, wie aufwendig und auch belastend die DFO-Therapie sein kann. Entscheidend ist der enge
Kontakt zwischen Patient/Eltern und den betreuenden Ärzten, sodass auftretende Probleme umgehend besprochen
werden können.
Insgesamt (und trotzdem) ist aus vielen Langzeitverläufen bewiesen, dass eine s.c. DFO-Therapie erfolgreich über
Jahrzehnte in der Praxis durchgeführt werden kann.
Pharmakokinetik und Pharmakodynamik
Ältere Arbeiten haben sich ausschließlich mit der i.v.-Infusion von DFO beschäftigt. In 11 Thalassämie-Patienten
wurde 50 mg/kg/24Stdn über 48 h infundiert (6). Dabei wurden seriell venöse Blutproben abgenommen und auf DFO,
FO und den eisenbindenden DFO-Metaboliten B analysiert. DFO wird unter diesen Bedingungen in einer
biphasischen Kinetik mit einer systematischen Clearance von 0.50 ± 0.24 Liter/Std/kg eliminiert. Die langsame
Halbwertszeit war 3.05 ± 1.30 Std. Der Hauptmetabolit (DFO-Metabolit B), der ebenfalls Eisen binden kann, erscheint
im Plasma meist mit einer kleineren Konzentration (191 ± 106 µMol/Liter/Std) als DFO selbst (AUC 354 ± 131
µMmol/Liter/Std.).
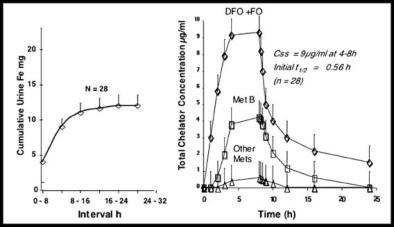
Für die in der Praxis wichtige s.c. Infusion. wurde erst vor kurzem eine Studie veröffentlicht (7). Bei einer Gruppe von
28 Patienten wurden 40 mg/kg DFO über 8 Stn. s.c. infundiert und engmaschig Blut- und Urin-Proben untersucht.
DFO und FO erreichen ein Maximum nach ca. 4 Stdn (Abb.4).
Abb.4: Pharmakokinetik und Pharmakodynamik von DFO in b-Thalassämiepatienten nach subkutaner Infusion (40
mg/kg über 8 Stdn.) (n=28) . Links: Urineisenauscheidung. Rechts: Plasmakurve der Konzentration von DFO und
Folgeprodukten (FO, Metabolit B). Modifiziert nach (1).
Die initiale Halbwertszeit im Plasma beträgt 0.56 Stdn, die terminale Halbwertszeit, die die Eliminierung von FO
repräsentiert beträgt 10 Stdn. Der pharmakodynamische Effekt der Urin-Eisen-Exkretion hält auch 10 Stdn nach
Absetzen der DFO-Infusion noch an. Dieser langwirkende Effekt sollte bei der Bestimmung von Eisen im Urin unter
DFO-Therapie beachtet werden.
Wirkung auf Eisenpools in Zellen und im Plasma
Überschüssiges Eisen kann prinzipiell in allen Zellen abgelagert werden. Mengenmäßig spielen aber vor allem zwei
Zelltypen eine wichtige Rolle: parenchymale Zellen und Zellen des Monozyten/Makrophagen-Systems (frühere
Bezeichnung: „retikuloendotheliales System”, RE. Parenchymale Eisenspeicherung z.B. in Hepatozyten resultiert
durch eine erhöhte Nahrungseisenaufnahme bei hereditärer Hämochromatose und wohl auch bei Thalassaemia
intermedia. Diese Eisenspeicher stehen in dynamischem Gleichgewicht mit dem Plasmatransferrin. Bei Patienten mit
unbehandelter Eisenüberladung ist der Turnover dieses Eisenpools sehr gering und es kommt leicht zu
eiseninduzierten Organschäden. Eisenüberladung in RE-Zellen der Milz, Leber (Kupffer-Zellen), Knochenmark und
endokrinen Organen wird als vergleichsweise harmlos eingestuft. Quelle der Eisenspeicherung in RE-Zellen ist der
Abbau von Hämoglobin aus alternden Erythrozyten. Die Aufnahme von Transferrin-Eisen ist gering, dagegen wird RE-
Eisen rasch ins Plasma entlassen, gebunden an Transferrin oder, bei Überschreiten der Bindungskapazität, in Form
von NTBI bereitgestellt.
Obwohl Deferoxamin schon seit mehreren Jahrzehnten am Patienten eingesetzt wird, ist seine genaue Wirkung auf
verschiedene Eisenpools bisher nicht gut verstanden. DFO ist positiv geladen, was die Aufnahme in Wirbeltierzellen
mit negativem Ruhepotential grundsätzlich begünstigt. Gegen eine leichte Aufnahme in Zellen sprechen jedoch das
hohe Molekulargewicht und die geringe Lipophilität der Substanz. Durch die aktuelle Diskussion um die mögliche
Überlegenheit von Deferipron in der Vorbeugung von eiseninduzierter Herzschädigung bei chronisch transfundierten
Patienten, wurde die Wirksamkeit von Desferal auf intrazelluläre Eisenpools, insbesondere auf Myocard-Eisen neu
untersucht (1).
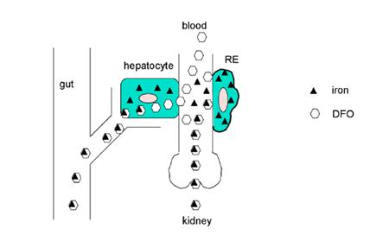
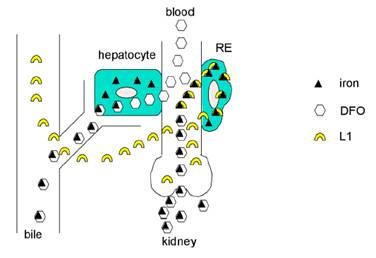
Danach wird DFO in Hepatozyten erleichtert aufgenommen, möglicherweise über einen allgemeinen Aufnahmeweg
für Amine, der nur in bestimmten Zelllinien gefunden wurde (8). Die Aufnahme in Erythrozyten unter gleichen
experimentellen Bedingungen ist dagegen 800-fach schlechter (1). Dies erklärt die gute Wirksamkeit von Desferal auf
hepatozelluläre Eisenspeicher und die Ausscheidung von Ferrioxamine über die Galle in den Stuhl. Eisen aus dem
Katabolismus von Hämoglobin wird von DFO auch cheliert, wobei die Reaktion offenbar an freiem Eisen im Plasma
(NTBI) angreift. Diese Eisenfraktion wird als Ferrioxamin (FO) über die Nieren ausgeschieden (Abb. 5).
Abb.5: DFO hat einen dualen Mechanismus. Es kann direkt in Hepatozyten permeiren und Eisen über die Galle
ausscheiden lassen. Urin-Eisen stammt hauptsächlich aus dem Abbau von Erythrozyten. Das hydrophile FO kann
gar nicht in Zellen eindringen. DFO wird nur gering von Zellen des RES aufgenommen (modifiziert nach 9)
Kürzlich wurde über neue immunohistochemische Untersuchungen in Myozyten berichtet (1). Unter Verwendung
eines Antikörpers gegen Ferrioxamin (bindet nicht an DFO) wurde auch bei nichteisenüberladenen Ratten eine
deutlich Anfärbung auch von FO in Myocyten nach 8h-subkutaner DFO-Infusion gesehen. DFO kann also sehr wohl in
Myocyten aufgenommen werden und dort Eisen binden. Möglicherweise ist aber der Abtransport von geladenem FO
aus Myocyten heraus ein Problem (Abb. 5)
Die Wirkung von DFO auf Eisen im Plasma richtet sich vor allem auf das "nicht-transferrin-gebundene" Eisen (NTBI).
Eine gängige Methode zur Bestimmung von NTBI ist die Inkubation mit NTA als Chelator, Filtration durch einen
Mikrofilter und Messung von Eisen im Filtrat. Nach Porter kann aber nur ca. 1/3 dieser NTBI-Fraktion in Patienten mit
b-Thalassämie von DFO gebunden und entfernt werden. Höherer DFO-Dosen binden nicht mehr NTBI (10).
Außerdem kommt es nach Absetzen des Chelators zu einem rebound-Phänomen, das umso größer ausfällt, je höher
die DFO-Dosis vorher war. Dies spricht insgesamt gegen eine "Start-Stopp"-Therapie und für eine kontinuierliche
Dosierung von DFO bei einer Chelattherapie (1).
Wirksamkeit bei Thalassämie-Patienten
Subkutane Infusion über 8-12 Std.
Die Standardtherapie mit Desferal® bei Patienten mit chronischer Transfusionstherapie besteht in einer subkutanen
Infusion einer 10 %igen wässrigen Lösung von Deferoxaminmesilat (40 mg/kg) nachts über 8-12 Std. an 5-6 Tagen
pro Woche. Eine Dosiserhöhung sollte nur in Einzelfällen mit schwerer Eisenüberladung erwogen werden, wobei der
Grenzwert des therapeutischen Index berücksichtigt werden sollte, um keine DFO-Nebenwirkungen (z.B.
Hörschädigung) zu riskieren. Bei Kindern mit bekannter transfusionspflichtiger Anämie, z.B. b-Thalassaemia major
sollte die Therapie mit DFO möglichst erst ab einem Alter von 3 Jahren beginnen (3). In diesem Alter liegt bereits
eine mittelgradige Eisenüberladung vor, sodass wenig Anlass für eine Überdosierung gegeben ist. Bei Erwachsenen
mit erworbener Transfusionspflichtigkeit ist der Beginn einer Eisenchelator schlechter definiert. Hierbei kann man sich
anhand der Zahl der Transfusionen (> 20), oder am erhöhten Serum-Ferritin (> 1000 µg/l) orientieren .
Die DFO-Applikation erfolgt heute über kleine und leise Mikroinjektorpumpen, die die vom Patienten angesetzte
Lösung zuverlässig injizieren. Mit diesen modernen Pumpen ist auch eine unauffällige Anwendung tagsüber leicht
möglich.
Vitamin C verbessert die Wirksamkeit der Eisenentspeicherung, allerdings wird vor der Anwendung von
unphysiologisch hohen Dosen (< 200 mg/Tag) gewarnt, weil es bei Patienten mit schwerer Eisenüberladung zu einer
Verschlechterung der Herzfunktion kommen kann. Auch Todesfälle sollen bei hochdosierter Vitamin-C-Medikation und
Eisenüberladung vorgekommen sein.
Über die Chelattherapie mit DFO liegen nach mehr als 30 Jahren der Anwendung unzählige Studien vor. In einer
Auswertung aus dem Jahre 2004 wurde die Überlebensrate und die Häufigkeit von Komplikationen von 977
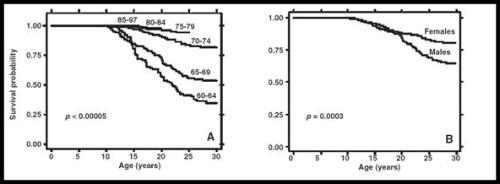
italienischen Patienten mit b-Thalassämie unter Desferaltherapie untersucht (4). Es ergab sich ein deutlicher
Zusammenhang zwischen der Überlebensrate und dem Jahrgang der Geburt. Je später die Geburt, desto besser die
Prognose (Abb. 6.6).
Weibliche Patienten haben eine bessere Prognose als männliche Patienten. Patienten in der jüngsten Kohorte hatten
weniger Herzprobleme, es gab in der Gruppe der 1980-1984 Geborenen nur einen herzbedingten Todesfall und in
späteren überhaupt keinen mehr. In der Gruppe der nach 1979 Geborenen zeigten dagegen 50 % Anzeichen von
Herzversagen.
In einzelnen Fällen unter regelmäßig durchgeführter Standard s.c. DFO-Therapie kann es offenbar bei b-
Thalassämie trotzdem zu einer gefährlichen Myokardsiderose kommen Anderson et al. beschrieben einen Patienten
mit vergleichweise niedrigem Serum-Ferritin und niedrigen Lebereisenwerten, der trotz zuverlässig durchgeführter
Standardtherapie eine progessive Myokardsiderose entwickelte, angezeigt durch einschlägige Parameter, inkl. eines
Abfalls des T2*-Wertes (vergl. Diagnostik, Herz-MRT) (11).
Abb. 6: Kaplan-Meier Überlebenskurven geordnet nach dem Jahrzehnt der Geburt (links), bzw. dem Geschlecht
(rechts). (modifiziert nach 4)
Eine Limitierung von DFO in der Verhinderung von gefährlichen Myokardsiderosen wird wohl auch aus der
Auswertung der Überlebensrate bei einer großen Gruppen von Thalassämie-Patienten aus Italien sichtbar, die im
Zeitraum von 1995 bis 2003 entweder nur mit DFO (n=359) oder nur mit DFP (n=157) behandelt wurden (12). Unter
3610 Patientenjahren unter DFO kam es zu 52 kardialen Zwischenfällen, von denen 10 tödlich endeten. Unter 750
DFP Patientenjahren kam es zu keinem Zwischenfall. Es bleibt aber vorher unklar und weitere kontrollierte Studien
sind nötig um zu klären, ob und warum DFO möglicherweise in einer Untergruppe von Thalassämiepatienten nicht
ausreichend bezüglich einer progressiven Myokardsiderose wirksam ist. Diese Befunde machen aber auch deutlich,
wie wichtig kardiale Verlaufskontrollen bei Patienten mit sekundärer Siderose sind.
Intensiv-i.v.Therapie
Für die Mehrzahl der Patienten ist eine 8-12 Std. s.c. Infusion von 30-50 mg DFO/kg während 5-6 Nächten/Woche
eine ausreichende Therapie mit seltenen adversen Effekten. Bei einer Gruppe von Patienten kommt, aus welchen
Gründen auch immer, mit dieser Standard-Therapie nicht zu Recht und entwickelt eine progressive Eisenüberladung
mit einem hohen Risiko für eine kardiale Dekompensation. Für diese Patienten kann eine i.v.-DFO-Therapie
lebensrettend sein. Verschiedene Protokolle wurden veröffentlicht. Einige Autoren wenden eine diskontinuierliche
Therapie (DFO<24 Stdn/Tag) (13, 14), andere eine kontinuierlich DFO-Infusion (15). In einer der größten Studien
bisher, berichteten Davies et al. über die Erfahrungen aus 16 Jahren mit einer kontinuierlichen DFO-Infusion bei
insgesamt 17 Patienten (15). Indikation für die Intensivtherapie waren kardiale Arrhythmie, Linksherzinsuffizienz,
schwere Eisenüberladung und Unverträglichkeit eine s.c. DFO-Therapie. Über einen implantierten Katheter wurde
DFO-infundiert. Die Dosis richtete sich nach der Höhe des Serum-Ferritins, wobei aber immer der Grenzwert des
therapeutischen Index beachtet wurde. Letztlich erhielten nur wenige Patienten eine Dosis > 50 mg/kg an 6-7
Tagen/Woche. Unter dieser Therapie war bei 6 von 6 Patienten die kardiale Symptomatik reversibel, die
linksventrikuläre Auswurffraktion verbesserte sich in 7 von 9 Patienten (von 36 ± 2 % auf 49 ± 3 %, Mittelwert ± SEM,
p=0.002, n=9). Katheterbedingte Komplikationen (Infektion, Thromboembolie) traten 1.15 bzw. 0.48 pro 1000
Kathetertage auf, nicht anders als bei anderen Patientenkollektiven. Unter der kontinuierlichen Behandlung mit i.v.
DFO (zwischen 68 und 1670 Kathethertagen) wurde auch der Grad der individuell vorhandenen Eisenüberladung
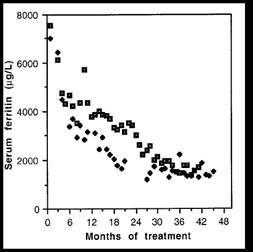
deutlich abgebaut (Serum Ferritin 6281 ± 562 µg/L auf 3736 ± 466 µg/L) (Abb. 7).
Abb. 7: Abnahme des Serum-Ferritins unter Behandlung mit kontinuierlicher i.v. DFO-Therapie (35-50 mg
DFO/kg/24h) über einen implantierten Port bei zwei Patienten mit ß-Thalassaemia major und schwerer
Eisenüberladung. (14)
Die Eisenentspeicherung durch eine i.v.-DFO-Therapie wirkt sich auch auf das Myocard aus. In einer Studie an 7
Thalassämie-Patienten mit Herzproblemen infolge zu geringer Compliance unter der Standard DFO-Therapie wurde
die i.v.-DFO-Therapie über 12 Monate mit verschiedenen diagnostischen Methoden überwacht, auch mit der neuen
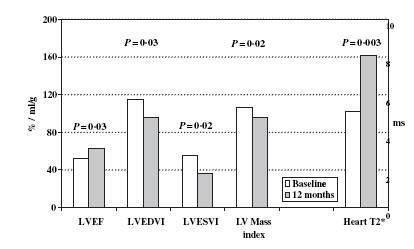
T2*-MRI-Technik (16). Ein Patient starb, bei den anderen wurde eine deutliche Verbesserung der myokardialen
Parameter gemessen: T2* (Anstieg von 5.1 ± 1.9 auf 8.1 ± 2.8 ms, P = 0.003), Leber-Eisen (Abnahme von 9.6 ±
4.3 auf 2.1 ± 1.5 mg/g, P = 0.001), linksventrikuläre-Ejektionsfraktion (Anstieg von 52 ± 7.1% auf 63 ± 6.4%, P =
0.03), linksventrikuläres Herzvolumen LV (Abnahme Enddiastolischer Volumenindex 115 ± 17 auf 96 ± 3 ml, P =
0.03; Endsystolischer Volumenindex 55 ± 16 auf 36 ± 6 ml, P = 0.01) and LV Massenindex (Abnahme 106 ± 14 auf 95
± 13, P = 0.01). Eisen aus dem Myokard wurde langsamer abgebaut als aus der Leber.
Diese Daten belegen, dass die Myokardsiderose unter einer i.v.DFO-Therapie häufig reversibel verläuft.
Abb. 8: Veränderungen in Parametern der linksventrikulären Herzfunktion vor und nach 12 Monaten einer i.v-
DFOTherapie LV, linker Ventrikel, EF, Ejektionsfraktion; EDVI, Enddiastolischer Volumenindex ESVI, Endsystolischer
Volumenindex (16)
Kombinationstherapie
Im Unterschied zur Monotherapie wird bei der Kombinationstherapie mehr als ein Chelator am gleichen Tag
eingenommen, wobei der Einnahmezeitpunkt der Substanzen aufgrund der kurzen Halbwertszeiten der Chelatoren
kritisch ist. Es kann nicht erwartet werden, dass bei einer sequenziellen Einnahme innerhalb eines Tages oder an
verschiedenen Tagen es zu einem Zusammenspiel beiden Substanzen z.B. im Blutplasma kommen kann. Die
alternierende Gabe von 2 Chelatoren an verschiedenen Tagen in der Woche kann also nur so wirksam sein, wie die
Summe der einzelnen Therapieeffekte.
Die „echte“ Kombination, also die gleichzeitige Gabe von zwei Chelatoren, einem , der leicht in Zellen penetrieren und
dort Eisen aufnehmen und heraustransportieren kann, mit einem stark bindenden Chelator, der im Plasma das Eisen
übernehmen und effizient über die Nieren ausscheiden lässt, kann eine Effizienzsteigerung einer Eisenchelattherapie
bewirken. Grady et al. haben in aufwendigen Eisenbilanzstudien an Patienten mit Thalassämie einen solchen
synergistischen Effekt zwischen DFO und DFP erstmals nachgewiesen (17). Patienten unter einer 8 stündigen s.c-
DFO-Infusionen erhielten nach 0, 4, 8 Stdn DFP. Dadurch konnte die Eisenausscheidung bei einigen Patienten um
240-340 % gesteigert werden. Ein Shuttle-Effekt zwischen DFO und
Abb. 9: In der Gegenwart von DFO könnte DFP als Shuttle-Molekül wirken, das schnell in Zellen permeieren, dort
Eisen aufnehmen und zurück im Extrazellularraum Eisen an das hochaffine DFO abgeben kann (modifiziert nach 9).
DFP kann auch direkt im Blutplasma von Thalassaemie-Patienten verfolgt werden. DFP-Behandlung führt zu einer
Akkumulation von cheliertem Eisen im Plasma mit einem Maximum 2 Std. nach Gabe (17). Die Zugabe von DFO führt
zu einem Transfer von DFP-Fe zu DFO-Fe und zu einem Anstieg des gesamten chelierten Eisens im Plasma. In einer
Reihe von Studien wurde die Verbesserung der Wirksamkeit und auch der Compliance durch eine kombinierte
DFO/DFP-Therapie bei Patienten mit b-Thalassämie nachgewiesen. Wonke et al. behandelten 13 Patienten, die mit
der vorher angesetzten oralen DFP-Therapie allein nicht ausreichend behandelt waren, zusätzlich zu DFP an 5 Tagen
mit einer DFO-Therapie (18). In allen Fällen resultierte erstmals ein Abfall des Serum-Ferritins als Zeichen einer
negativen Eisenbilanz. Der Effekt auf die Urin-Fe-Exkretion scheint unter diesen Bedingungen additiv zu sein.
Inzwischen wurden für eine solche Kombinationstherapie Behandlungsdauern von über einem Jahr beschrieben,
ohne dass eine neue Art von Nebenwirkung erkennbar war (19). Diese Behandlungsform wird als besonders effizient
eingeschätzt und ist gut geeignet für Patienten, die mit einer Standard DFO oder DFP-Therapie nicht ausreichend
therapierbar sind, oder die DFO nur an wenigen Tagen in der Woche einnehmen können.
Mit einer Kombinationstherapie von DFO und DFP wurden auch Fälle mit schwerem Herzversagen erfolgreich
behandelt (20, 21).
Durch die potentiellen Möglichkeiten von synergistischen Effekten in einer Kombinationstherapie werden jetzt erneut
Chelatoren untersucht, die allein zu keiner negativen Eisenbilanz bei Patienten mit Eisenüberladungserkrankungen
führen, wie z.B. HBED (22).
DFO mit verlängerter Halbwertszeit
Es wurden verschiedene Versuche unternommen, die Wirksamkeit von DFO zu erhöhen. Eine Variante ist die
Erhöhung des Molekulargewichtes durch Bindung von DFO an Hydroxyethyl-Stärke, was zu einer lang anhaltenden
Wirkung führen soll. In einer klinischen Studie wurden hohe Plasmakonzentration des Eisenchelators von bis zu 3 mM
nach 4 h-intravenöser Applikation gefunden (23). Trotzdem war die klinische Testung dieser Substanz eher
enttäuschend wegen einer offenbar zu geringen Eisenausscheidung (24). Was letztlich aus dieser Entwicklung wird ist
z.Zt. unklar. Gleiches gilt offenbar auch für eine von der Fa. Novartis entwickelte „slow-release-Präparation“ von DFO.
Auch hier reicht die Effektivität in der Eisenmobilisierung offenbar nicht aus (24).
Nebenwirkungen
Unerwünschte Wirkung bis hin zu toxischen Reaktionen von DFO in Patienten mit b-Thalassämie sind abhängig von
der täglichen Dosis, dem Alter des Patienten und dem Grad der vorliegenden Eisenüberladung. Eine DFO-Therapie
sollte grundsätzlich nicht zu früh (< ca. 3 Jahre) begonnen werden, die Standarddosis von 40 mg/kg/Tag sollte nur in
begründeten Fällen überschritten werden und die Dosis sollte bei Verringerung der Eisenüberladung entsprechend
reduziert werden (1-5).
Retinale Schädigung
Am längsten bekannt ist eine Schädigung der Retina und des Nervus Optikus, die bei Patienten beschrieben wurde,
die eine sehr hohe DFO-Dosis (125 mg/kg/d) erhielten. Die Symptome reichen von verschwommener Sicht,
Nachlassen der Sehschärfe, Sehverlust, Farbsehstörung, Nachtblindheit, Gesichtsfeldeinschränkung, Skotom,
Retinopathie, Sehnerv-Neuritis, Katarakt, Korneatrübung.
Das Risiko scheint besonders bei Patienten mit Diabetes groß zu sein, sodass vor allem hier eine
Elektroretinographie als regelmäßige Untersuchungsmethode anzuraten ist. Nach Stopp der Therapie verschwinden
die Symptome meist nach 1-2 Monaten, ansonsten drohen irreversible Schäden.
Hörschädigung
Ein hochfrequenter sensorineuraler Hörverlust wird relativ häufig (25 %), insbesondere bei Patienten unter
hochdosierter DFO-Therapie beobachtet. Bei frühzeitiger Diagnose können diese Schäden reversibel sein (25).
Wachtumsstörungen
Eine Eisenüberladung der Hypophyse ist genauso schädlich wie eine zu hochdosierte DFO-Therapie. Bei Kindern mit
chronischer Transfusionstherapie aber ohne Gabe von Eisenchelatoren führt die Eisenüberladung zu einer starken
Wachstumshemmung infolge hypogonadotropen Hypogonadismus. Wenn Kinder allerdings zu früh (<3 Jahre) zu
intensiv cheliert werden (> 60 mg/kg) kommt es ebenfalls zu einer Beeinträchtigung des Körperwachstums. Unterhalb
von 40 mg/kg Körpergewicht ist das Risiko deutlich geringer. Mit dieser Chelator-induzierten Schädigung können
Veränderungen des Knochenstoffwechsels verbunden sein (Metaphyseale Dysplasie), die einer Rachitis ähneln
können.
Lokale Reaktionen an der Infusionsstelle
Lokale Reaktionen mit Rötung, Schwellung, Schmerzen um die Einstichstelle sind bei s.c. DFO-Infusion sehr häufig.
Hier hilft in vielen Fällen eine niedrigdosierte Cortisontherapie (5-10 mg/Infusion). In einigen Fällen entwickelt sich
eine pseudoallergische Reaktion mit starker Schwellung und Hautrötung. In solchen Fällen wurde eine i.v.DFO-
Infusion aber problemlos vertragen, was gegen eine systemische Reaktion spricht. Sehr selten kann es aber auch zu
typischen anaphylaktischen Reaktionen kommen. Einzelne Fälle einer erfolgreichen Desensibilisierung sind
beschrieben (26-28).
Infektionen
Es sind Fälle bekannt, bei denen es bei eisenüberladenen Patienten unter DFO-Therapie zu systemischen
Infektionen mit Yersinia enterocolitica, Yersinia pseudotuberculosis oder auch Klebsiella gekommen ist. Diese
Bakterien können Ferrioxamin als Eisenquelle für ihre Vermehrung benutzen. Implantierte Ports sind bei diesen
Patienten problematisch, weil der Patient in der Eigenbehandlung oftmals nicht steril genug arbeitet. Wenn unter
Desferal-Therapie Fieber verbunden mit akuter Enteritis/Enterokolitis, diffusen Bauchschmerzen oder Pharyngitis
auftritt, sollte die Behandlung vorübergehend abgesetzt und entsprechende bakteriologische Untersuchungen sowie
eine zweckmäßige antibiotische Therapie unverzüglich eingeleitet werden. Nach Abheilung der Infektion kann die
Behandlung mit Desferal fortgesetzt werden.
Therapeutischer Index
Bezüglich der DFO-induzierten Hörschädigung tragen Patienten mit niedriger Eisenbeladung und hoher DFO-Dosis
das größte Risiko. Porter hat dazu einen therapeutischen Index formuliert, der Dosis und Ferritin-Wert in Beziehung
setzt (TI= Dosis DFO in mg/kg geteilt durch den Serum-Ferritin-Wert in µg/L) (29). Dieser Wert sollte stets unter 0.025
liegen. Fällt der Ferritinwert ab, sollte die Dosis vermindert werden. Verwendet man als besseres Maß für den Grad
der individuellen Eisenbeladung statt des Serum-Ferritins die Lebereisenkonzentration, so kann ein Speichereisen-
basierter Chelatorindex definiert werden (30,31). Der Grenzwert für den Therapeutischen Index von 0.025
(mg/kg/Tag)/(µg/L) entspricht dabei einem Chelatorindex von 1.2 mMol/d/g Leber-Fe. Es gibt eine Reihe von
eisenüberladenen Patienten, bei denen das Serum-Ferritin nicht zu der individuellen vorhandenen Lebersiderose
"passt". Es bleibt abzuwarten, inwieweit der Chelatorindex speziell in solchen Fällen von Vorteil ist.
Literatur
6. Lee P, Mohammed N, Marshall L, Abeysinghe RD, Hider RC, Porter JB, Singh S. Intravenous infusion
pharmacokinetics of desferrioxamine in thalassaemic patients. Drug Metab Dispos 1993; 21:640-644
7. Porter J, Davis B, Weir T, Alberti D, Voi V, Piga A, Taraglia N, Howes C, Osborne S, Brockman L, Hassan I,
McCombie R, Walker S, Lowe P. Preliminary findings with single dose evaluation of a new depot formulation of
deferoxamine (ICL 749B) for transfusion-dependent beta-thalassemia. In: Iron Chelators, New Development
Strategies. Saratoga Group, Ponte Vedra Beach , Florida USA . 2000
8. Busch AE, Quester S, Ulzheimer JC, Waldegger S, Gorboulev V, Arndt P, Lang F, Koepsell H. Electrogenic
properties and substrate specificity of the polyspecific rat cation transporter rOCT1. J Biol Chem 1996;
271:32599–32604
9. Hershko C, Link G, Konijn AM, Cabantschik ZI. Objectives and Mechanism of Iron Chelation Therapy. Ann NY
Acad Sci 2005; 1054:124-135
10. Porter JB, Abeysinghe RD , Marshall L, Hider RC, Singh S. Kinetics of removal and reappearance of non-
transferrinbound plasma iron with desferrioxamine therapy. Blood 1996; 88:705–714
11. Anderson LJ, Westwood MA, Prescott E, Malcolm Walker, Pennell D, Wonke B. Development of
Thalassaemic Iron Overload Cardiomyopathy despite Low Liver Iron Levels and Meticulous Compliance to
Desferrioxamine. Acta Haematol 2006; 115:106–108
12. Borgna-Pignatti C, Cappellini MD, De Stefano P, Carlo Del Vecchio G, Forni GL, Gamberoni MR, Ghilardi R,
Piga A, Romeo MA, Zhao H, Cnaan A. Cardiac morbidity and mortality in deferoxamine- or deferiprone-treated
patients with thalassemia major. Blood, 2006; 107:3733 - 3737
13. Cohen AR, Martin M, Schwartz E. Current treatment of Cooley’s anemia. Ann N Y Acad Sci 1990; 612:286
14. Tamary H, Goshen J, Carmi D, Yaniv I, Kaplinsky C, Cohen IJ, Zaizov R.. Long-term intravenous
deferoxamine treatment for non-compliant transfusion dependent beta-thalassemia patients. Isr J Med Sci. 1994;
30:658
15. Davies BA, Porter JB. Long-term outcome of continuous 24-hour deferoxamine infusion via indwelling
intravenous catheters in high-risk beta-thalassemia. Blood 2000; 95:1229–1236
16. Anderson LJ, Westwood MA, Holden S, Davis B, Prescott E, Wonke B, Porter JB, Walker JM, Pennell DJ.
Myocardial iron clearance during reversal of siderotic cardiomyopathy with intravenous desferrioxamine: a prospective
study using T2* cardiovascular magnetic resonance. Br J Haematol 2004; 127:348–355
17. Grady RW, Berdoukas VA , Rachmilewitz EA, Giardina PJ. Iron chelation therapy: a better approach. The
7th International Conference on Thalassaemia and the Haemoglobinopathies. Bangkok , Thailand , 31 May-4 June
1999:Abstract 0018
18. Wonke B, Wright C, Hoffbrand AV. Combined therapy with deferiprone and desferrioxamine. Br J Haematol
1998; 103:361–364
19. Alymara V, Bourantas D, Chaidos A, Bouranta P, Gouva M, Vassou A, Tzouvara E, Bourantas KL.
Effectiveness and safety of combined iron-chelation therapy with deferoxamine and deferiprone Hematol J 2004;
5:475-479
20. Tsironi M, Deftereos S, Andriopoulos P, Farmakis D, Meletis J, Aessopos A. Reversal of heart failure in
thalassemia major by combined chelation therapy: a case report Eur J Haematol 2005; 74:84–85
21. Wu KH, Chang JS, Tsai CH, Peng CT. Combined therapy with deferiprone and desferrioxamine successfully
regresses severe heart failure in patients with beta-thalassemia major. Ann-Hematol. 2004; 83:471-473
22. Grady RW, Giardina PJ . Oral iron chelation: a potential role for HBED in combination therapy. American
Society of Hematology, 41st Annual Meeting.December 1999. Blood 94(Suppl. 1): Abstr. 3293
23. Dragsten PR, Hallaway PE , Hanson GJ, Berger AE, Bernard B, and Hedlund BE. First human studies with
a high-molecular-weight iron chelator. J Lab Clin 2000; Med 135:57–65
24. Galanello R. Iron chelation: new therapies. Semin Hematol 2001; 38:73-76
25. Porter JB. Deferoxamine pharmacokinetics. Semin-Hematol. 2001; 38:63-68
26. La Rosa M, Romeo MA, Di Gregorio F, Russo G. Desensitization treatment for anaphylactoid reactions to
desferrioxamine in a pediatric patient with thalassemia. J Allergy Clin Immunol 1996; 97:127-128
27. Patriarca G, Schiavino D, Nucera E, Pellegrino S, Valle D, Della Corte AM, Pagliari G. Successful
desensitization of a child with desferrioxamine hypersensitivity. J Investig Allergol Clin Immunol 1995; 5:294-2
28. Bousquet J, Navarro M, Robert G, Aye P, Michel FB. Rapid desensitisation for desferrioxamine anaphylactoid
reaction. Lancet 1983; 2(8354):859-860
29. Porter JB, Jaswon MS, Huehns ER. Desferrioxamine ototoxicity: evaluation of risk factors in thalassaemic
patients and guidelines for safe dosage. Br J Haematol 1989;73:403–409
30. Nielsen P, Kordes U, Fischer R., Engelhardt R, Janka GE. SQUID-Biosuszeptometrie bei
Eisenüberladungskrankheiten in der Haematologie. Klin Paediatr 2002; 214:218–222
31. Fischer R, Piga A, Harmatz P, Nielsen P. Monitoring Long-Term Efficacy of Iron Chelation Treatment with
Biomagnetic Liver Susceptometry. Ann NY Acad Sci 2005; 1054:350–357











© www.eiseninfo.de
Therapie mit Deferoxamine
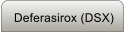
Deferoxamin B (Desferal ®, DFO) ist ein Siderophor aus
Streptomyces pilosus (Abb. 1). Die 6 Bindungsstellen für
Eisen werden aus drei Hydroxamsäuregruppen gebildet,
die insgesamt einen 6-zähnigen Eisenchelator formieren,
der eine hohe Affinität für Fe(III) aufweist (pM 27.7).
DFO ist ein vergleichsweise großes, hydrophiles Molekül
und wird damit intestinal schlecht absorbiert (s. Tabelle
5.2 Kap. 5.2.3), so dass nur eine parenterale Applikation
(subkutan, intramuskulär oder intravenös) möglich ist.
Alle Derivatisierungsversuche haben bisher nicht zu
einer besseren Chelatorvariante als der natürliche
Siderophor DFO selbst geführt.
Abb. 1: Struktur von Feroxamin (FO) mit seinen
sechs Bindungsstellen für Eisen Einfaches Modell
eines „zweizähnigen“ Eisenchelators
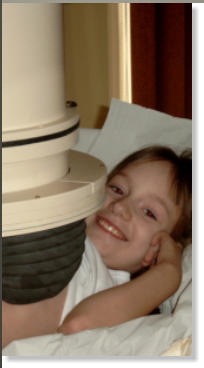
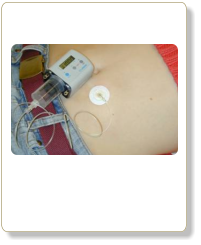
Eisenchelatortherapie
Subkutane Therapie mit Desferal mit einer kleinen Pumpe meist über Nacht.