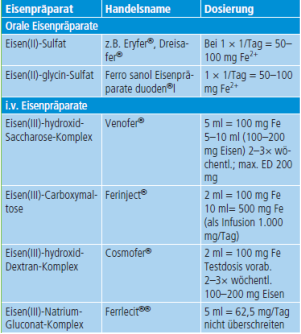
Tabelle 1: Einige Präparate zur oralen und parenteralen Behandlung eines Eisenmangels (aus P. Nielsen “Eisen –
Pharmakotherapie von Eisenmangel und Eisenüberladung” in Allgemeine und Spezielle Pharmakologie und
Toxikologie, eds Aktories, Förstermann, Hofmann, Starke, 11. Auflage, Elsevier 2013)
Alle diese Präparate enthalten hochmolekulare Eisen(III)verbindungen, einen polymerenEisen(III)-Oxid-Hydroxid-
Kern verbunden mit einer Kohlenhydrathülle, die in wässriger Lösung kolloid gelöst sind. Nach i.v.-Therapie ist die
Stabilität dieser Verbindungen im Plasma unterschiedlich. Eisen-Dextrane und Eisen-Carboxymaltose sind sehr
stabil und geben z.B. kein ionisches Eisen an Apotransferrin ab, während Ferrlecit und Venofer schnell zu hohen
Transferrin-Eisen-Sättigungen führen. Besonders die hochmolekularen Verbindungen werden hauptsächlich von
Makrophagen aufgenommen und im RES-System der Leber gespeichert bzw. abgebaut. Durch Reduktion wird
intrazellulär in Lysosomen Fe2+ gebildet, das über normale Eisentransportmechanismen über DMT1 aus
Lysosomen, über Ferroportin aus der Zelle heraustransportiert werden kann und dann für die Bindung an
Apotransferrin zur Verfügung steht.
Anerkannte Indikation für eine i.v.-Eisentherapie ist die Behandlung von Eisenmangelanämie bei Patienten unter
chronischer Hämodialyse (2-5). Eine Eisensupplementation ist hier notwendig, um die Erythropoese unter einer
exogenen Gabe von rekombinantem humanen Erythropoetin (r-HuEPO) ausreichend mit Eisen zu versorgen. Da
bei Dialysepatienten die intestinale Absorption trotz Eisenbedarf und Eisenmangel häufig nicht adäquat
hochreguliert ist, sind viele Patienten auf eine intravenöse Eisentherapie angewiesen.
Indikationen für eine intravenöse Eisentherapie
•
Patienten mit renaler Anämie unter r-HuEPO-Therapie
•
Patienten mit M. Crohn/Colitis ulcerosa
•
Therapieversager einer orale Eisentherapie
•
Patienten mit Anämie bei chronischer Herzinsuffizienz
•
Patienten mit Restless Legs Syndrom
Empfohlene Richtgrößen bezüglich Hb-Wert eine Eisenparameter sind in Tabelle 1 dargestellt, wobei klar ist, dass
die Definition von Eisenmangel bei Patienten mit renaler Anämie sehr problematisch ist. Ein Ferritinwert > 500
ng/ml wird üblicherweise als Abbruchkriterium für eine Eisentherapie gesehen.
Parameter
EBPG 2004*  KDOQI 2006/2007+
KDOQI 2006/2007+ Definition
Definition Hb < 11.5 g/dl bei Frauen
Hb < 11.5 g/dl bei Frauen Hb< 12 g/dl bei Frauen
Hb< 12 g/dl bei Frauen der Anämie
Hb < 13.5 g/dl bei Männern < 70 J
der Anämie
Hb < 13.5 g/dl bei Männern < 70 J Hb < 12 g/dl bei Männern > 70 J
Hb < 12 g/dl bei Männern > 70 J Ziel-Hb
Ziel-Hb Hb > 11 (nicht > 14 g/dl)
Hb > 11 (nicht > 14 g/dl) Hb > 11-12 (nicht > 13 g/dl)
Hb > 11-12 (nicht > 13 g/dl) Ziel Eisentherapie
Ziel Eisentherapie Tf-Sätt 30-40 %
Tf-Sätt 30-40 % Ferritin nicht > 500 ng/ml
Ferritin nicht > 500 ng/ml Ferritin 200-500 ng/ml
Ferritin 200-500 ng/ml Definition Eisenmangel
Definition Eisenmangel Ferritin < 100 mg/ml
Ferritin < 100 mg/ml Ferritin < 100-200 ng/ml
Ferritin < 100-200 ng/ml * Working Group of European Renal Best Practice (ERBP)
+Kidney Disease Outcome Quality Initiative KDOQI
Tabelle 1. Empfehlungen zur Eisentherapie bei renaler Anämie in Verbindung mit r-HuEPO-Therapie (6)
In der DRIVE-Studie („Dialysis patients’ response to i.v. iron with elevated ferritin“) wurden 134 Patienten mit
hohen Ferritin (500–1200 ng/ml) bei niedriger Transferrineisensättigung (< 25 %) mit rHuEPO und nach 6 Wochen
mit 8x 125 mg Eisen (Ferrlecit) behandelt (6). Gegenüber einer Kontrollgruppe kam es zu einem signifkanten Hb-
Anstieg, was auf einen vormals funktionellen Eisenmangel bei diesen Patienten hindeuten würde.
Eine weitere Indikation für i.v.-Fe sind Patienten mit chronisch entzündlichen Darmerkrankungen. Eine orale
* Working Group of European Renal Best Practice (ERBP)
+Kidney Disease Outcome Quality Initiative KDOQI
Tabelle 1. Empfehlungen zur Eisentherapie bei renaler Anämie in Verbindung mit r-HuEPO-Therapie (6)
In der DRIVE-Studie („Dialysis patients’ response to i.v. iron with elevated ferritin“) wurden 134 Patienten mit
hohen Ferritin (500–1200 ng/ml) bei niedriger Transferrineisensättigung (< 25 %) mit rHuEPO und nach 6 Wochen
mit 8x 125 mg Eisen (Ferrlecit) behandelt (6). Gegenüber einer Kontrollgruppe kam es zu einem signifkanten Hb-
Anstieg, was auf einen vormals funktionellen Eisenmangel bei diesen Patienten hindeuten würde.
Eine weitere Indikation für i.v.-Fe sind Patienten mit chronisch entzündlichen Darmerkrankungen. Eine orale Eisentherapie ist hier zwar evtl. auch wirksam, aber orales Fe(II) könnte aktiv am Entzündungsprozess teilnehmen,
Eisentherapie ist hier zwar evtl. auch wirksam, aber orales Fe(II) könnte aktiv am Entzündungsprozess teilnehmen, was an erhöhten Parametern für oxidativen Stress bei diesen Patienten erkennbar ist (7).
was an erhöhten Parametern für oxidativen Stress bei diesen Patienten erkennbar ist (7).  Eine schon immer gegebene Indikation sind Fälle, in denen die orale Eisentherapie nicht wirksam ist oder wegen
Eine schon immer gegebene Indikation sind Fälle, in denen die orale Eisentherapie nicht wirksam ist oder wegen Nebenwirkungen abgebrochen werden muss. Hier sollte die i.v.-Therapie als „second-line“ treatment durchgeführt
Nebenwirkungen abgebrochen werden muss. Hier sollte die i.v.-Therapie als „second-line“ treatment durchgeführt werden, um Bluttransfusionen als „ultima ratio“ zu vermeiden.
Eine neue Indikation ist der Einsatz von i.v.-Eisenpräparaten bei Patienten mit Anämie bei chronischer
Herzinsuffizienz. Hier deutet sich an, das diese Patienten einen schweren Eisenmangel aufweisen
(Eisenmalsborption bei chronisch erhöhten Hepcidinwerten?) und von einer i.v.-Eisentherapie profitieren.
Die Problematik bei Restless Legs wurde bereits erwähnt (vergl. Risikogruppen für Eisenmangel). Hier ist eine i.v.-
Fe-Therapie evtl. besser wirksam als die orale Eisentherapie.
Dosierung einer i.v.-Eisentherapie
Die Dosierung einer i.v-Eisentherapie ist nicht unproblematisch, wenn hohe Dosen (1 g Fe und mehr) in kurzer Zeit
zugeführt werden sollen. Diese Menge übertrifft die normale Speichereisenmenge deutlich, d.h. bei unkritischer
wiederholter Dosierung kann eine Eisenüberladung induziert werden. Solche hohen Dosen sollten also nur bei
anämischen Patienten eingesetzt werden, bei denen ein Eisenmangel als Ursache auch wirklich feststeht und die
Erythropoese mit dieser Eisenmasse auch umgehen kann.
Bei der Dosierung einer parenteralen Eisentherapie wird die erforderliche Gesamtdosis von den Herstellern der
Präparate mit einer Formel nach Ganzoni angegeben (8):
Gesamteisendefizit [mg] =
Körpergewicht [KG] in kg × (Soll-Hb* – Ist-Hb) [g/dl]× 2,4 + Reserveeisen [mg]**,
wobei
* Soll-Hb für ein KG unter 35 kg = 13 g/dl; über 35 kg = 15 g/dl. ** Reserveeisen für ein KG bis 35 kg = 15 mg/kg
KG, über 35 kg = 500 mg/kg KG.
Das ergibt für typische Fälle mit Hb-Werten von 7-10 g/dl eine Gesamtdosis von 1500 mg bei KG < 70 kg und 2000
mg bei KG > 70 kg.
Nebenwirkungen einer parenteralen Eisentherapie
Die intravenöse Eisentherapie wird seit mehr als 50 Jahren besonders von vielen älteren Experten für relativ
gefährlich gehalten, hauptsächlich wegen der Berichte über schwere anaphylaktische Reaktionen mit Todesfolge.
Diese betrafen früher das schlecht charakterisierte hoch-molekulare Eisen-Dextran-Präparat Imferon® (inzwischen
vom Markt), und gelten heute offenbar noch für das hoch-molekulare Eisen-Dextran Dexferrum®, das in den USA
aktuell (noch) zugelassen ist. Bei den neueren, niedermolekularen Präparaten wie Ferrlicit® oder Venofer® sind
diese Reaktionen wohl deutlich deutlich seltener geworden, können aber grundsätzlich im Einzelfall immer noch
auftreten. (Abb. 1) (9)
Abb. 1
werden, um Bluttransfusionen als „ultima ratio“ zu vermeiden.
Eine neue Indikation ist der Einsatz von i.v.-Eisenpräparaten bei Patienten mit Anämie bei chronischer
Herzinsuffizienz. Hier deutet sich an, das diese Patienten einen schweren Eisenmangel aufweisen
(Eisenmalsborption bei chronisch erhöhten Hepcidinwerten?) und von einer i.v.-Eisentherapie profitieren.
Die Problematik bei Restless Legs wurde bereits erwähnt (vergl. Risikogruppen für Eisenmangel). Hier ist eine i.v.-
Fe-Therapie evtl. besser wirksam als die orale Eisentherapie.
Dosierung einer i.v.-Eisentherapie
Die Dosierung einer i.v-Eisentherapie ist nicht unproblematisch, wenn hohe Dosen (1 g Fe und mehr) in kurzer Zeit
zugeführt werden sollen. Diese Menge übertrifft die normale Speichereisenmenge deutlich, d.h. bei unkritischer
wiederholter Dosierung kann eine Eisenüberladung induziert werden. Solche hohen Dosen sollten also nur bei
anämischen Patienten eingesetzt werden, bei denen ein Eisenmangel als Ursache auch wirklich feststeht und die
Erythropoese mit dieser Eisenmasse auch umgehen kann.
Bei der Dosierung einer parenteralen Eisentherapie wird die erforderliche Gesamtdosis von den Herstellern der
Präparate mit einer Formel nach Ganzoni angegeben (8):
Gesamteisendefizit [mg] =
Körpergewicht [KG] in kg × (Soll-Hb* – Ist-Hb) [g/dl]× 2,4 + Reserveeisen [mg]**,
wobei
* Soll-Hb für ein KG unter 35 kg = 13 g/dl; über 35 kg = 15 g/dl. ** Reserveeisen für ein KG bis 35 kg = 15 mg/kg
KG, über 35 kg = 500 mg/kg KG.
Das ergibt für typische Fälle mit Hb-Werten von 7-10 g/dl eine Gesamtdosis von 1500 mg bei KG < 70 kg und 2000
mg bei KG > 70 kg.
Nebenwirkungen einer parenteralen Eisentherapie
Die intravenöse Eisentherapie wird seit mehr als 50 Jahren besonders von vielen älteren Experten für relativ
gefährlich gehalten, hauptsächlich wegen der Berichte über schwere anaphylaktische Reaktionen mit Todesfolge.
Diese betrafen früher das schlecht charakterisierte hoch-molekulare Eisen-Dextran-Präparat Imferon® (inzwischen
vom Markt), und gelten heute offenbar noch für das hoch-molekulare Eisen-Dextran Dexferrum®, das in den USA
aktuell (noch) zugelassen ist. Bei den neueren, niedermolekularen Präparaten wie Ferrlicit® oder Venofer® sind
diese Reaktionen wohl deutlich deutlich seltener geworden, können aber grundsätzlich im Einzelfall immer noch
auftreten. (Abb. 1) (9)
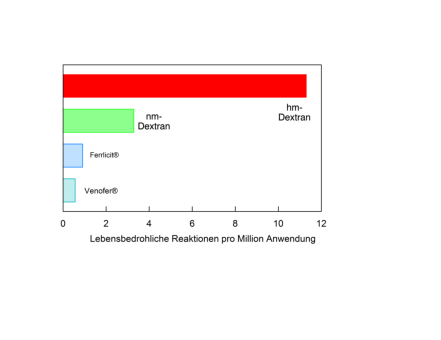
Abb. 1  Relative Raten von berichteten lebensbedrohlichen Nebenwirkungen von vier verschiedenen
Relative Raten von berichteten lebensbedrohlichen Nebenwirkungen von vier verschiedenen parenteralen Eisenpräparaten. nach Daten von Chertow et al. (9), FDA Medwatch Report 1001-2003,
parenteralen Eisenpräparaten. nach Daten von Chertow et al. (9), FDA Medwatch Report 1001-2003,  Von dem neueren Präparaten (Ferinject®, MonoFer®) gibt es diesbezüglich noch wenig bis keine Angaben. In
Von dem neueren Präparaten (Ferinject®, MonoFer®) gibt es diesbezüglich noch wenig bis keine Angaben. In Publikationen eines Herstellers ist man optimistisch, das optimale Eisenpräparat anbieten zu können (10).
Was von allen i.v.-Präparaten weniger bekannt ist und weniger beachtet wird, ist die genaue Metabolisierung
Publikationen eines Herstellers ist man optimistisch, das optimale Eisenpräparat anbieten zu können (10).
Was von allen i.v.-Präparaten weniger bekannt ist und weniger beachtet wird, ist die genaue Metabolisierung dieser hochmolekularen Verbindungen in-vivo. Es gibt eine Reihe von Untersuchungen, die zeigen, dass diese
dieser hochmolekularen Verbindungen in-vivo. Es gibt eine Reihe von Untersuchungen, die zeigen, dass diese Moleküle im Blut und in Zellen unterschiedlich schnell Eisen freisetzen und dass dadurch durchaus adverse
Moleküle im Blut und in Zellen unterschiedlich schnell Eisen freisetzen und dass dadurch durchaus adverse Reaktionen hergerufen werden können (11). Genau genommen gilt dies auch für die orale Eisentherapie. Wir
Reaktionen hergerufen werden können (11). Genau genommen gilt dies auch für die orale Eisentherapie. Wir haben unlängst eine Fraktion von nicht-transferrin-gebundenem Eisen im Plasma von Freiwilligen nach Einnahme
haben unlängst eine Fraktion von nicht-transferrin-gebundenem Eisen im Plasma von Freiwilligen nach Einnahme von 100 mg Eisen nachgewiesen, die potentiell katalytisch aktiv sein kann (12). Diese Effekte sind nach
von 100 mg Eisen nachgewiesen, die potentiell katalytisch aktiv sein kann (12). Diese Effekte sind nach parenteraler Therapie aber auch bekannt, wobei NTBI hier in weitaus höheren Konzentrationen „erzeugt“ wird (13).
parenteraler Therapie aber auch bekannt, wobei NTBI hier in weitaus höheren Konzentrationen „erzeugt“ wird (13).  Ein Risiko für eine chronische Toxizität bei einer parenteralen Eisentherapie ist die Möglichkeit der ungewollten
Ein Risiko für eine chronische Toxizität bei einer parenteralen Eisentherapie ist die Möglichkeit der ungewollten Induktion einer „iatrogenen“ Eisenüberladung. Besonders bei Injektion von stabilen Verbindungen kann es zu einer
Induktion einer „iatrogenen“ Eisenüberladung. Besonders bei Injektion von stabilen Verbindungen kann es zu einer Speicherung von Eisen in langlebigen Zellen kommen. Vor 40 Jahren wurde bereits für diese Speicherung von
Speicherung von Eisen in langlebigen Zellen kommen. Vor 40 Jahren wurde bereits für diese Speicherung von Eisen der Begriff „residuelle Endothelsiderose“ geprägt (14). Wenn man mit einzelnen iv.-Fe-Präparaten 1-2 g
Eisen der Begriff „residuelle Endothelsiderose“ geprägt (14). Wenn man mit einzelnen iv.-Fe-Präparaten 1-2 g Eisen/Sitzung infundieren kann, dann besteht im Einzelfall ein Risiko, auch eine Eisenüberladung zu erzeugen.
Eisen/Sitzung infundieren kann, dann besteht im Einzelfall ein Risiko, auch eine Eisenüberladung zu erzeugen.  Es sei daran erinnert, dass man an anderer Stelle aktuell mögliche Schäden einer Eisenüberladung als Cofaktor
Es sei daran erinnert, dass man an anderer Stelle aktuell mögliche Schäden einer Eisenüberladung als Cofaktor bei Arteriosklerose, Krebsentstehung, Diabetes intensiv diskutiert (15). Genaue Richtlinien und diagnostische
bei Arteriosklerose, Krebsentstehung, Diabetes intensiv diskutiert (15). Genaue Richtlinien und diagnostische Parameter sind zukünftig notwendig, um genau dies zu verhindern. Zumindest bei Patienten mit chronischer
Parameter sind zukünftig notwendig, um genau dies zu verhindern. Zumindest bei Patienten mit chronischer Anämie ist der Ferritinwert dafür denkbar ungeeignet, wenn Ferritin-Werte um 1000 ng/ml im Einzelfall sowohl
Anämie ist der Ferritinwert dafür denkbar ungeeignet, wenn Ferritin-Werte um 1000 ng/ml im Einzelfall sowohl Eisenüberladung aber auch funktioneller Eisenmangel bedeuten kann.
Ein bisher ungelöstes Problem von i.v.-Eisenpräparaten bleibt das Risiko für mögliche schwere bis
Eisenüberladung aber auch funktioneller Eisenmangel bedeuten kann.
Ein bisher ungelöstes Problem von i.v.-Eisenpräparaten bleibt das Risiko für mögliche schwere bis lebensbedrohliche allergische Reaktionen, mögen sie auch nur sehr selten auftreten. Aufgrund dieser
lebensbedrohliche allergische Reaktionen, mögen sie auch nur sehr selten auftreten. Aufgrund dieser  Sicherheitsbedenken wurde auf europäischer Ebene eine Bewertung des Nutzen-Risiko-Profils der Präparate
Sicherheitsbedenken wurde auf europäischer Ebene eine Bewertung des Nutzen-Risiko-Profils der Präparate vorgenommen. Daraus haben sich neue Empfehlungen zur Anwendung ergeben, die die Hersteller der betroffenen
vorgenommen. Daraus haben sich neue Empfehlungen zur Anwendung ergeben, die die Hersteller der betroffenen Präparate jetzt in einem sogenannten “Rote-Hand-Brief” an alle Deutschen Ärzte und Apotheker verschickt
Präparate jetzt in einem sogenannten “Rote-Hand-Brief” an alle Deutschen Ärzte und Apotheker verschickt haben (16), bei denen es um die besondere Vorsicht bei Allergikern und bei Schwangeren geht und geraten wird,
haben (16), bei denen es um die besondere Vorsicht bei Allergikern und bei Schwangeren geht und geraten wird, Maßnahmen zur Schockbehandlung vorzuhalten.
Maßnahmen zur Schockbehandlung vorzuhalten.  Literatur
Literatur 1.
Auerbach M, Ballard H, Glaspy H. Comment. Clinical update: intravenous iron for anaemia. Lancet. 2007; 369:1502-4
2.
Aljama P, Bommer J, Canaud B, Carrera F, Eckardt KU, Hörl WH, Krediet RT, Locatelli F, Macdougall IC, Wikström B;
NESP Usage Guidelines Group.
3.
Practical guidelines for the use of NESP in treating renal anaemia. Nephrol Dial Transplant 2001; 16:22-28
4.
Locatelli F, Nissenson AR, Barrett BJ, Walker RG, Wheeler DC, Eckardt KU, Lameire NH, Eknoyan G.et al. Clinical
practice guidelines for anemia in chronic kidney disease: problems and solutions. A position statement from Kidney
Disease: Improving Global Outcomes (KDIGO). Kidney Int 2008; 74(10): 1237–1240
5.
Locatelli F, Covic A, Eckardt KU, Wiecek A, Vanholder R. Anaemia management in patients with chronic kidney disease:
a position statement by the Anaemia Working Group of European Renal Best Practice (ERBP). Nephrol Dial Transplant
2008; 1-7 doi:10.1093/ndt/gfn653
6.
Coyne DW, Kapoian T, Suki W et al. DRIVE Study Group. Ferric gluconate is highly efficacious in anemic hemodialysis
patients with high serum ferritin and low transferrin saturation: results of the Dialysis Patients’ Response to IV Iron with
Elevated Ferritin (DRIVE) Study. J Am Soc Nephrol 2007; 18: 975–984
7.
Erichsen K, Hausken T, Ulvik RJ, Svardal A, Berstad A, Berge RK. Ferrous fumarate deteriorated plasma antioxidant
status in patients with Crohn disease. Scand J Gastroenterol 2003; 38, 543-548
8.
Ganzoni AM. Intravenous iron-dextran: therapeutic and experimental possibilities. Schweiz Med Wochenschr
1970;100:301–303.
9.
Chertow GM, Mason PD, Vaage-Nilsen O, Ahlmen J. Update on adverse drug events associated with parenteral iron.
Nephrol Dial Transplant 2006; 21: 378–82.
10.
Geisser P. The pharmacology and safety profile of ferric carboxymaltose (Ferinject®): structure/reactivity relationship of
iron preparations. Port J Nephrol Hypert 2009; 23:11-16
11.
Sturm S, Goldenberg H, Scheiber-Mojdehkar B. Transient increase of the labile iron pool in HepG2 cells by intravenous
iron preparations. Eur J Biochem 2007; 270: 3731–3738
12.
Dresow B, Petersen D, Fischer R, Nielsen P. Non-transferrin-bound iron in plasma following administration of oral iron
drugs. Biometals 2008;21:273-276
13.
Espósito BP, Breuer W, Slotki I, Cabantchik ZI. Labile iron in parenteral iron formulations and its potential for generating
plasma nontransferrin-bound iron in dialysis patients. Eur J Clin Invest. 2002; Suppl 1:42-9
14.
Hausmann K, Wulfhekel U, Diillmann J, Kuse R. Iron Storage in Macrophages and Endothelial Cells. Histochemistry,
Ultrastructure, and Clinical Significance. Blut 1976; 32:289-295
15.
Weinberg ED. Iron therapy and cancer. Kidney Int Suppl. 1999; 69:S131-
16.
Rote-Hand-Brief Rote-Hand-Brief zu parenteralen eisenhaltigen Arzneimitteln: Risiko schwerer
Überempfindlichkeitsreaktionen. 28.10.2013 Bfarm
http://www.bfarm.de/SharedDocs/Risikoinformationen/DE/RHB/2013/rhb-eisen-iv.html
1.
Auerbach M, Ballard H, Glaspy H. Comment. Clinical update: intravenous iron for anaemia. Lancet. 2007; 369:1502-4
2.
Aljama P, Bommer J, Canaud B, Carrera F, Eckardt KU, Hörl WH, Krediet RT, Locatelli F, Macdougall IC, Wikström B;
NESP Usage Guidelines Group.
3.
Practical guidelines for the use of NESP in treating renal anaemia. Nephrol Dial Transplant 2001; 16:22-28
4.
Locatelli F, Nissenson AR, Barrett BJ, Walker RG, Wheeler DC, Eckardt KU, Lameire NH, Eknoyan G.et al. Clinical
practice guidelines for anemia in chronic kidney disease: problems and solutions. A position statement from Kidney
Disease: Improving Global Outcomes (KDIGO). Kidney Int 2008; 74(10): 1237–1240
5.
Locatelli F, Covic A, Eckardt KU, Wiecek A, Vanholder R. Anaemia management in patients with chronic kidney disease:
a position statement by the Anaemia Working Group of European Renal Best Practice (ERBP). Nephrol Dial Transplant
2008; 1-7 doi:10.1093/ndt/gfn653
6.
Coyne DW, Kapoian T, Suki W et al. DRIVE Study Group. Ferric gluconate is highly efficacious in anemic hemodialysis
patients with high serum ferritin and low transferrin saturation: results of the Dialysis Patients’ Response to IV Iron with
Elevated Ferritin (DRIVE) Study. J Am Soc Nephrol 2007; 18: 975–984
7.
Erichsen K, Hausken T, Ulvik RJ, Svardal A, Berstad A, Berge RK. Ferrous fumarate deteriorated plasma antioxidant
status in patients with Crohn disease. Scand J Gastroenterol 2003; 38, 543-548
8.
Ganzoni AM. Intravenous iron-dextran: therapeutic and experimental possibilities. Schweiz Med Wochenschr
1970;100:301–303.
9.
Chertow GM, Mason PD, Vaage-Nilsen O, Ahlmen J. Update on adverse drug events associated with parenteral iron.
Nephrol Dial Transplant 2006; 21: 378–82.
10.
Geisser P. The pharmacology and safety profile of ferric carboxymaltose (Ferinject®): structure/reactivity relationship of
iron preparations. Port J Nephrol Hypert 2009; 23:11-16
11.
Sturm S, Goldenberg H, Scheiber-Mojdehkar B. Transient increase of the labile iron pool in HepG2 cells by intravenous
iron preparations. Eur J Biochem 2007; 270: 3731–3738
12.
Dresow B, Petersen D, Fischer R, Nielsen P. Non-transferrin-bound iron in plasma following administration of oral iron
drugs. Biometals 2008;21:273-276
13.
Espósito BP, Breuer W, Slotki I, Cabantchik ZI. Labile iron in parenteral iron formulations and its potential for generating
plasma nontransferrin-bound iron in dialysis patients. Eur J Clin Invest. 2002; Suppl 1:42-9
14.
Hausmann K, Wulfhekel U, Diillmann J, Kuse R. Iron Storage in Macrophages and Endothelial Cells. Histochemistry,
Ultrastructure, and Clinical Significance. Blut 1976; 32:289-295
15.
Weinberg ED. Iron therapy and cancer. Kidney Int Suppl. 1999; 69:S131-
16.
Rote-Hand-Brief Rote-Hand-Brief zu parenteralen eisenhaltigen Arzneimitteln: Risiko schwerer
Überempfindlichkeitsreaktionen. 28.10.2013 Bfarm
http://www.bfarm.de/SharedDocs/Risikoinformationen/DE/RHB/2013/rhb-eisen-iv.html
 KDOQI 2006/2007+
KDOQI 2006/2007+ Definition
Definition Hb < 11.5 g/dl bei Frauen
Hb < 11.5 g/dl bei Frauen Hb< 12 g/dl bei Frauen
Hb< 12 g/dl bei Frauen der Anämie
Hb < 13.5 g/dl bei Männern < 70 J
der Anämie
Hb < 13.5 g/dl bei Männern < 70 J Hb < 12 g/dl bei Männern > 70 J
Hb < 12 g/dl bei Männern > 70 J Ziel-Hb
Ziel-Hb Hb > 11 (nicht > 14 g/dl)
Hb > 11 (nicht > 14 g/dl) Hb > 11-12 (nicht > 13 g/dl)
Hb > 11-12 (nicht > 13 g/dl) Ziel Eisentherapie
Ziel Eisentherapie Tf-Sätt 30-40 %
Tf-Sätt 30-40 % Ferritin nicht > 500 ng/ml
Ferritin nicht > 500 ng/ml Ferritin 200-500 ng/ml
Ferritin 200-500 ng/ml Definition Eisenmangel
Definition Eisenmangel Ferritin < 100 mg/ml
Ferritin < 100 mg/ml Ferritin < 100-200 ng/ml
Ferritin < 100-200 ng/ml * Working Group of European Renal Best Practice (ERBP)
+Kidney Disease Outcome Quality Initiative KDOQI
Tabelle 1. Empfehlungen zur Eisentherapie bei renaler Anämie in Verbindung mit r-HuEPO-Therapie (6)
In der DRIVE-Studie („Dialysis patients’ response to i.v. iron with elevated ferritin“) wurden 134 Patienten mit
hohen Ferritin (500–1200 ng/ml) bei niedriger Transferrineisensättigung (< 25 %) mit rHuEPO und nach 6 Wochen
mit 8x 125 mg Eisen (Ferrlecit) behandelt (6). Gegenüber einer Kontrollgruppe kam es zu einem signifkanten Hb-
Anstieg, was auf einen vormals funktionellen Eisenmangel bei diesen Patienten hindeuten würde.
Eine weitere Indikation für i.v.-Fe sind Patienten mit chronisch entzündlichen Darmerkrankungen. Eine orale
* Working Group of European Renal Best Practice (ERBP)
+Kidney Disease Outcome Quality Initiative KDOQI
Tabelle 1. Empfehlungen zur Eisentherapie bei renaler Anämie in Verbindung mit r-HuEPO-Therapie (6)
In der DRIVE-Studie („Dialysis patients’ response to i.v. iron with elevated ferritin“) wurden 134 Patienten mit
hohen Ferritin (500–1200 ng/ml) bei niedriger Transferrineisensättigung (< 25 %) mit rHuEPO und nach 6 Wochen
mit 8x 125 mg Eisen (Ferrlecit) behandelt (6). Gegenüber einer Kontrollgruppe kam es zu einem signifkanten Hb-
Anstieg, was auf einen vormals funktionellen Eisenmangel bei diesen Patienten hindeuten würde.
Eine weitere Indikation für i.v.-Fe sind Patienten mit chronisch entzündlichen Darmerkrankungen. Eine orale Eisentherapie ist hier zwar evtl. auch wirksam, aber orales Fe(II) könnte aktiv am Entzündungsprozess teilnehmen,
Eisentherapie ist hier zwar evtl. auch wirksam, aber orales Fe(II) könnte aktiv am Entzündungsprozess teilnehmen, was an erhöhten Parametern für oxidativen Stress bei diesen Patienten erkennbar ist (7).
was an erhöhten Parametern für oxidativen Stress bei diesen Patienten erkennbar ist (7).  Eine schon immer gegebene Indikation sind Fälle, in denen die orale Eisentherapie nicht wirksam ist oder wegen
Eine schon immer gegebene Indikation sind Fälle, in denen die orale Eisentherapie nicht wirksam ist oder wegen Nebenwirkungen abgebrochen werden muss. Hier sollte die i.v.-Therapie als „second-line“ treatment durchgeführt
Nebenwirkungen abgebrochen werden muss. Hier sollte die i.v.-Therapie als „second-line“ treatment durchgeführt werden, um Bluttransfusionen als „ultima ratio“ zu vermeiden.
Eine neue Indikation ist der Einsatz von i.v.-Eisenpräparaten bei Patienten mit Anämie bei chronischer
Herzinsuffizienz. Hier deutet sich an, das diese Patienten einen schweren Eisenmangel aufweisen
(Eisenmalsborption bei chronisch erhöhten Hepcidinwerten?) und von einer i.v.-Eisentherapie profitieren.
Die Problematik bei Restless Legs wurde bereits erwähnt (vergl. Risikogruppen für Eisenmangel). Hier ist eine i.v.-
Fe-Therapie evtl. besser wirksam als die orale Eisentherapie.
Dosierung einer i.v.-Eisentherapie
Die Dosierung einer i.v-Eisentherapie ist nicht unproblematisch, wenn hohe Dosen (1 g Fe und mehr) in kurzer Zeit
zugeführt werden sollen. Diese Menge übertrifft die normale Speichereisenmenge deutlich, d.h. bei unkritischer
wiederholter Dosierung kann eine Eisenüberladung induziert werden. Solche hohen Dosen sollten also nur bei
anämischen Patienten eingesetzt werden, bei denen ein Eisenmangel als Ursache auch wirklich feststeht und die
Erythropoese mit dieser Eisenmasse auch umgehen kann.
Bei der Dosierung einer parenteralen Eisentherapie wird die erforderliche Gesamtdosis von den Herstellern der
Präparate mit einer Formel nach Ganzoni angegeben (8):
Gesamteisendefizit [mg] =
Körpergewicht [KG] in kg × (Soll-Hb* – Ist-Hb) [g/dl]× 2,4 + Reserveeisen [mg]**,
wobei
* Soll-Hb für ein KG unter 35 kg = 13 g/dl; über 35 kg = 15 g/dl. ** Reserveeisen für ein KG bis 35 kg = 15 mg/kg
KG, über 35 kg = 500 mg/kg KG.
Das ergibt für typische Fälle mit Hb-Werten von 7-10 g/dl eine Gesamtdosis von 1500 mg bei KG < 70 kg und 2000
mg bei KG > 70 kg.
Nebenwirkungen einer parenteralen Eisentherapie
Die intravenöse Eisentherapie wird seit mehr als 50 Jahren besonders von vielen älteren Experten für relativ
gefährlich gehalten, hauptsächlich wegen der Berichte über schwere anaphylaktische Reaktionen mit Todesfolge.
Diese betrafen früher das schlecht charakterisierte hoch-molekulare Eisen-Dextran-Präparat Imferon® (inzwischen
vom Markt), und gelten heute offenbar noch für das hoch-molekulare Eisen-Dextran Dexferrum®, das in den USA
aktuell (noch) zugelassen ist. Bei den neueren, niedermolekularen Präparaten wie Ferrlicit® oder Venofer® sind
diese Reaktionen wohl deutlich deutlich seltener geworden, können aber grundsätzlich im Einzelfall immer noch
auftreten. (Abb. 1) (9)
Abb. 1
werden, um Bluttransfusionen als „ultima ratio“ zu vermeiden.
Eine neue Indikation ist der Einsatz von i.v.-Eisenpräparaten bei Patienten mit Anämie bei chronischer
Herzinsuffizienz. Hier deutet sich an, das diese Patienten einen schweren Eisenmangel aufweisen
(Eisenmalsborption bei chronisch erhöhten Hepcidinwerten?) und von einer i.v.-Eisentherapie profitieren.
Die Problematik bei Restless Legs wurde bereits erwähnt (vergl. Risikogruppen für Eisenmangel). Hier ist eine i.v.-
Fe-Therapie evtl. besser wirksam als die orale Eisentherapie.
Dosierung einer i.v.-Eisentherapie
Die Dosierung einer i.v-Eisentherapie ist nicht unproblematisch, wenn hohe Dosen (1 g Fe und mehr) in kurzer Zeit
zugeführt werden sollen. Diese Menge übertrifft die normale Speichereisenmenge deutlich, d.h. bei unkritischer
wiederholter Dosierung kann eine Eisenüberladung induziert werden. Solche hohen Dosen sollten also nur bei
anämischen Patienten eingesetzt werden, bei denen ein Eisenmangel als Ursache auch wirklich feststeht und die
Erythropoese mit dieser Eisenmasse auch umgehen kann.
Bei der Dosierung einer parenteralen Eisentherapie wird die erforderliche Gesamtdosis von den Herstellern der
Präparate mit einer Formel nach Ganzoni angegeben (8):
Gesamteisendefizit [mg] =
Körpergewicht [KG] in kg × (Soll-Hb* – Ist-Hb) [g/dl]× 2,4 + Reserveeisen [mg]**,
wobei
* Soll-Hb für ein KG unter 35 kg = 13 g/dl; über 35 kg = 15 g/dl. ** Reserveeisen für ein KG bis 35 kg = 15 mg/kg
KG, über 35 kg = 500 mg/kg KG.
Das ergibt für typische Fälle mit Hb-Werten von 7-10 g/dl eine Gesamtdosis von 1500 mg bei KG < 70 kg und 2000
mg bei KG > 70 kg.
Nebenwirkungen einer parenteralen Eisentherapie
Die intravenöse Eisentherapie wird seit mehr als 50 Jahren besonders von vielen älteren Experten für relativ
gefährlich gehalten, hauptsächlich wegen der Berichte über schwere anaphylaktische Reaktionen mit Todesfolge.
Diese betrafen früher das schlecht charakterisierte hoch-molekulare Eisen-Dextran-Präparat Imferon® (inzwischen
vom Markt), und gelten heute offenbar noch für das hoch-molekulare Eisen-Dextran Dexferrum®, das in den USA
aktuell (noch) zugelassen ist. Bei den neueren, niedermolekularen Präparaten wie Ferrlicit® oder Venofer® sind
diese Reaktionen wohl deutlich deutlich seltener geworden, können aber grundsätzlich im Einzelfall immer noch
auftreten. (Abb. 1) (9)
Abb. 1  Relative Raten von berichteten lebensbedrohlichen Nebenwirkungen von vier verschiedenen
Relative Raten von berichteten lebensbedrohlichen Nebenwirkungen von vier verschiedenen parenteralen Eisenpräparaten. nach Daten von Chertow et al. (9), FDA Medwatch Report 1001-2003,
parenteralen Eisenpräparaten. nach Daten von Chertow et al. (9), FDA Medwatch Report 1001-2003,  Von dem neueren Präparaten (Ferinject®, MonoFer®) gibt es diesbezüglich noch wenig bis keine Angaben. In
Von dem neueren Präparaten (Ferinject®, MonoFer®) gibt es diesbezüglich noch wenig bis keine Angaben. In Publikationen eines Herstellers ist man optimistisch, das optimale Eisenpräparat anbieten zu können (10).
Was von allen i.v.-Präparaten weniger bekannt ist und weniger beachtet wird, ist die genaue Metabolisierung
Publikationen eines Herstellers ist man optimistisch, das optimale Eisenpräparat anbieten zu können (10).
Was von allen i.v.-Präparaten weniger bekannt ist und weniger beachtet wird, ist die genaue Metabolisierung dieser hochmolekularen Verbindungen in-vivo. Es gibt eine Reihe von Untersuchungen, die zeigen, dass diese
dieser hochmolekularen Verbindungen in-vivo. Es gibt eine Reihe von Untersuchungen, die zeigen, dass diese Moleküle im Blut und in Zellen unterschiedlich schnell Eisen freisetzen und dass dadurch durchaus adverse
Moleküle im Blut und in Zellen unterschiedlich schnell Eisen freisetzen und dass dadurch durchaus adverse Reaktionen hergerufen werden können (11). Genau genommen gilt dies auch für die orale Eisentherapie. Wir
Reaktionen hergerufen werden können (11). Genau genommen gilt dies auch für die orale Eisentherapie. Wir haben unlängst eine Fraktion von nicht-transferrin-gebundenem Eisen im Plasma von Freiwilligen nach Einnahme
haben unlängst eine Fraktion von nicht-transferrin-gebundenem Eisen im Plasma von Freiwilligen nach Einnahme von 100 mg Eisen nachgewiesen, die potentiell katalytisch aktiv sein kann (12). Diese Effekte sind nach
von 100 mg Eisen nachgewiesen, die potentiell katalytisch aktiv sein kann (12). Diese Effekte sind nach parenteraler Therapie aber auch bekannt, wobei NTBI hier in weitaus höheren Konzentrationen „erzeugt“ wird (13).
parenteraler Therapie aber auch bekannt, wobei NTBI hier in weitaus höheren Konzentrationen „erzeugt“ wird (13).  Ein Risiko für eine chronische Toxizität bei einer parenteralen Eisentherapie ist die Möglichkeit der ungewollten
Ein Risiko für eine chronische Toxizität bei einer parenteralen Eisentherapie ist die Möglichkeit der ungewollten Induktion einer „iatrogenen“ Eisenüberladung. Besonders bei Injektion von stabilen Verbindungen kann es zu einer
Induktion einer „iatrogenen“ Eisenüberladung. Besonders bei Injektion von stabilen Verbindungen kann es zu einer Speicherung von Eisen in langlebigen Zellen kommen. Vor 40 Jahren wurde bereits für diese Speicherung von
Speicherung von Eisen in langlebigen Zellen kommen. Vor 40 Jahren wurde bereits für diese Speicherung von Eisen der Begriff „residuelle Endothelsiderose“ geprägt (14). Wenn man mit einzelnen iv.-Fe-Präparaten 1-2 g
Eisen der Begriff „residuelle Endothelsiderose“ geprägt (14). Wenn man mit einzelnen iv.-Fe-Präparaten 1-2 g Eisen/Sitzung infundieren kann, dann besteht im Einzelfall ein Risiko, auch eine Eisenüberladung zu erzeugen.
Eisen/Sitzung infundieren kann, dann besteht im Einzelfall ein Risiko, auch eine Eisenüberladung zu erzeugen.  Es sei daran erinnert, dass man an anderer Stelle aktuell mögliche Schäden einer Eisenüberladung als Cofaktor
Es sei daran erinnert, dass man an anderer Stelle aktuell mögliche Schäden einer Eisenüberladung als Cofaktor bei Arteriosklerose, Krebsentstehung, Diabetes intensiv diskutiert (15). Genaue Richtlinien und diagnostische
bei Arteriosklerose, Krebsentstehung, Diabetes intensiv diskutiert (15). Genaue Richtlinien und diagnostische Parameter sind zukünftig notwendig, um genau dies zu verhindern. Zumindest bei Patienten mit chronischer
Parameter sind zukünftig notwendig, um genau dies zu verhindern. Zumindest bei Patienten mit chronischer Anämie ist der Ferritinwert dafür denkbar ungeeignet, wenn Ferritin-Werte um 1000 ng/ml im Einzelfall sowohl
Anämie ist der Ferritinwert dafür denkbar ungeeignet, wenn Ferritin-Werte um 1000 ng/ml im Einzelfall sowohl Eisenüberladung aber auch funktioneller Eisenmangel bedeuten kann.
Ein bisher ungelöstes Problem von i.v.-Eisenpräparaten bleibt das Risiko für mögliche schwere bis
Eisenüberladung aber auch funktioneller Eisenmangel bedeuten kann.
Ein bisher ungelöstes Problem von i.v.-Eisenpräparaten bleibt das Risiko für mögliche schwere bis lebensbedrohliche allergische Reaktionen, mögen sie auch nur sehr selten auftreten. Aufgrund dieser
lebensbedrohliche allergische Reaktionen, mögen sie auch nur sehr selten auftreten. Aufgrund dieser  Sicherheitsbedenken wurde auf europäischer Ebene eine Bewertung des Nutzen-Risiko-Profils der Präparate
Sicherheitsbedenken wurde auf europäischer Ebene eine Bewertung des Nutzen-Risiko-Profils der Präparate vorgenommen. Daraus haben sich neue Empfehlungen zur Anwendung ergeben, die die Hersteller der betroffenen
vorgenommen. Daraus haben sich neue Empfehlungen zur Anwendung ergeben, die die Hersteller der betroffenen Präparate jetzt in einem sogenannten “Rote-Hand-Brief” an alle Deutschen Ärzte und Apotheker verschickt
Präparate jetzt in einem sogenannten “Rote-Hand-Brief” an alle Deutschen Ärzte und Apotheker verschickt haben (16), bei denen es um die besondere Vorsicht bei Allergikern und bei Schwangeren geht und geraten wird,
haben (16), bei denen es um die besondere Vorsicht bei Allergikern und bei Schwangeren geht und geraten wird, Maßnahmen zur Schockbehandlung vorzuhalten.
Maßnahmen zur Schockbehandlung vorzuhalten.  Literatur
Literatur 1.
Auerbach M, Ballard H, Glaspy H. Comment. Clinical update: intravenous iron for anaemia. Lancet. 2007; 369:1502-4
2.
Aljama P, Bommer J, Canaud B, Carrera F, Eckardt KU, Hörl WH, Krediet RT, Locatelli F, Macdougall IC, Wikström B;
NESP Usage Guidelines Group.
3.
Practical guidelines for the use of NESP in treating renal anaemia. Nephrol Dial Transplant 2001; 16:22-28
4.
Locatelli F, Nissenson AR, Barrett BJ, Walker RG, Wheeler DC, Eckardt KU, Lameire NH, Eknoyan G.et al. Clinical
practice guidelines for anemia in chronic kidney disease: problems and solutions. A position statement from Kidney
Disease: Improving Global Outcomes (KDIGO). Kidney Int 2008; 74(10): 1237–1240
5.
Locatelli F, Covic A, Eckardt KU, Wiecek A, Vanholder R. Anaemia management in patients with chronic kidney disease:
a position statement by the Anaemia Working Group of European Renal Best Practice (ERBP). Nephrol Dial Transplant
2008; 1-7 doi:10.1093/ndt/gfn653
6.
Coyne DW, Kapoian T, Suki W et al. DRIVE Study Group. Ferric gluconate is highly efficacious in anemic hemodialysis
patients with high serum ferritin and low transferrin saturation: results of the Dialysis Patients’ Response to IV Iron with
Elevated Ferritin (DRIVE) Study. J Am Soc Nephrol 2007; 18: 975–984
7.
Erichsen K, Hausken T, Ulvik RJ, Svardal A, Berstad A, Berge RK. Ferrous fumarate deteriorated plasma antioxidant
status in patients with Crohn disease. Scand J Gastroenterol 2003; 38, 543-548
8.
Ganzoni AM. Intravenous iron-dextran: therapeutic and experimental possibilities. Schweiz Med Wochenschr
1970;100:301–303.
9.
Chertow GM, Mason PD, Vaage-Nilsen O, Ahlmen J. Update on adverse drug events associated with parenteral iron.
Nephrol Dial Transplant 2006; 21: 378–82.
10.
Geisser P. The pharmacology and safety profile of ferric carboxymaltose (Ferinject®): structure/reactivity relationship of
iron preparations. Port J Nephrol Hypert 2009; 23:11-16
11.
Sturm S, Goldenberg H, Scheiber-Mojdehkar B. Transient increase of the labile iron pool in HepG2 cells by intravenous
iron preparations. Eur J Biochem 2007; 270: 3731–3738
12.
Dresow B, Petersen D, Fischer R, Nielsen P. Non-transferrin-bound iron in plasma following administration of oral iron
drugs. Biometals 2008;21:273-276
13.
Espósito BP, Breuer W, Slotki I, Cabantchik ZI. Labile iron in parenteral iron formulations and its potential for generating
plasma nontransferrin-bound iron in dialysis patients. Eur J Clin Invest. 2002; Suppl 1:42-9
14.
Hausmann K, Wulfhekel U, Diillmann J, Kuse R. Iron Storage in Macrophages and Endothelial Cells. Histochemistry,
Ultrastructure, and Clinical Significance. Blut 1976; 32:289-295
15.
Weinberg ED. Iron therapy and cancer. Kidney Int Suppl. 1999; 69:S131-
16.
Rote-Hand-Brief Rote-Hand-Brief zu parenteralen eisenhaltigen Arzneimitteln: Risiko schwerer
Überempfindlichkeitsreaktionen. 28.10.2013 Bfarm
http://www.bfarm.de/SharedDocs/Risikoinformationen/DE/RHB/2013/rhb-eisen-iv.html
1.
Auerbach M, Ballard H, Glaspy H. Comment. Clinical update: intravenous iron for anaemia. Lancet. 2007; 369:1502-4
2.
Aljama P, Bommer J, Canaud B, Carrera F, Eckardt KU, Hörl WH, Krediet RT, Locatelli F, Macdougall IC, Wikström B;
NESP Usage Guidelines Group.
3.
Practical guidelines for the use of NESP in treating renal anaemia. Nephrol Dial Transplant 2001; 16:22-28
4.
Locatelli F, Nissenson AR, Barrett BJ, Walker RG, Wheeler DC, Eckardt KU, Lameire NH, Eknoyan G.et al. Clinical
practice guidelines for anemia in chronic kidney disease: problems and solutions. A position statement from Kidney
Disease: Improving Global Outcomes (KDIGO). Kidney Int 2008; 74(10): 1237–1240
5.
Locatelli F, Covic A, Eckardt KU, Wiecek A, Vanholder R. Anaemia management in patients with chronic kidney disease:
a position statement by the Anaemia Working Group of European Renal Best Practice (ERBP). Nephrol Dial Transplant
2008; 1-7 doi:10.1093/ndt/gfn653
6.
Coyne DW, Kapoian T, Suki W et al. DRIVE Study Group. Ferric gluconate is highly efficacious in anemic hemodialysis
patients with high serum ferritin and low transferrin saturation: results of the Dialysis Patients’ Response to IV Iron with
Elevated Ferritin (DRIVE) Study. J Am Soc Nephrol 2007; 18: 975–984
7.
Erichsen K, Hausken T, Ulvik RJ, Svardal A, Berstad A, Berge RK. Ferrous fumarate deteriorated plasma antioxidant
status in patients with Crohn disease. Scand J Gastroenterol 2003; 38, 543-548
8.
Ganzoni AM. Intravenous iron-dextran: therapeutic and experimental possibilities. Schweiz Med Wochenschr
1970;100:301–303.
9.
Chertow GM, Mason PD, Vaage-Nilsen O, Ahlmen J. Update on adverse drug events associated with parenteral iron.
Nephrol Dial Transplant 2006; 21: 378–82.
10.
Geisser P. The pharmacology and safety profile of ferric carboxymaltose (Ferinject®): structure/reactivity relationship of
iron preparations. Port J Nephrol Hypert 2009; 23:11-16
11.
Sturm S, Goldenberg H, Scheiber-Mojdehkar B. Transient increase of the labile iron pool in HepG2 cells by intravenous
iron preparations. Eur J Biochem 2007; 270: 3731–3738
12.
Dresow B, Petersen D, Fischer R, Nielsen P. Non-transferrin-bound iron in plasma following administration of oral iron
drugs. Biometals 2008;21:273-276
13.
Espósito BP, Breuer W, Slotki I, Cabantchik ZI. Labile iron in parenteral iron formulations and its potential for generating
plasma nontransferrin-bound iron in dialysis patients. Eur J Clin Invest. 2002; Suppl 1:42-9
14.
Hausmann K, Wulfhekel U, Diillmann J, Kuse R. Iron Storage in Macrophages and Endothelial Cells. Histochemistry,
Ultrastructure, and Clinical Significance. Blut 1976; 32:289-295
15.
Weinberg ED. Iron therapy and cancer. Kidney Int Suppl. 1999; 69:S131-
16.
Rote-Hand-Brief Rote-Hand-Brief zu parenteralen eisenhaltigen Arzneimitteln: Risiko schwerer
Überempfindlichkeitsreaktionen. 28.10.2013 Bfarm
http://www.bfarm.de/SharedDocs/Risikoinformationen/DE/RHB/2013/rhb-eisen-iv.html